Как известно, жизнь на Земле невозможна без протекания химических реакций. Они составляют основу создания и существования большинства современных предметов. Без химических реакций нашу планету не защищал бы озоновый слой, в недрах земли не скрывались бы полезные ископаемые. Поэтому химические реакции – одна из самых важных вещей на Земле, а их изучение – сложный, но очень полезный процесс.
Но охватить всю суть химических реакций в одном реферате невозможно. Можно лишь описать какую-то их сторону. Именно поэтому я и выбрала в качестве темы своего исследования, наверное, один из самых интересных и уж точно один из самых важных аспектов химических реакций – тепловой эффект.
Тепловые эффекты химических реакций необходимы для многих технических расчетов. Они находят обширное применение во многих отраслях промышленности, а также в военных разработках. Знание теплового эффекта также важно для решения многих практических задач. Посредством химических реакций с тепловым эффектом в наших квартирах горит газ, идет горячая вода, есть электричество, благодаря именно этому типу химических реакция ездят наши автомобили, летают ракеты и самолеты. Все реакции горения – суть тепловые реакции. Порох, огнестрельное оружие, сварка и резка металлов, промышленные лазеры… Химические реакции везде.
Иными словами, химические реакции c тепловым эффектом вошли в современную жизнь человека и общества. Именно потому, что сейчас они являются неотъемлемой частью нашей жизни, и следует обратить особое внимание на эту тему. Именно поэтому эта тема выбрана нами для написания реферата.
Цель исследования – разносторонне изучить и явление теплового эффекта и возможность его применения на практике. Этой цели можно достигнуть, решив несколько поставленных нами задач:
1. Познакомиться с понятием термодинамики и ее основными аспектами;
2. Изучить раздел термодинамики, называемый термохимией;
3. Понять, что такое тепловой эффект и каково его значение в химии;
4. Узнать о разных способах применения полученных знаний в жизни.
§1. Теоретические знания о тепловом эффекте.
Основные понятия термодинамики.
Термодинамика
Термодинамика исторически возникла как эмпирическая (экспериментальная) наука об основных способах преобразования внутренней энергии тел для совершения механической работы. Однако в процессе своего развития термодинамика проникла во все разделы физики, где возможно ввести понятие «температура» и позволила теоретически предсказать многие явления задолго до появления строгой теории этих явлений.
Философские вопросы химии и их влияние на дальнейшее развитие химической науки
... Теории и факты химической науки предоставляют нам конкретные доказательства научности основных положений диалектики, и поэтому основной целью этого реферата является задача показать с помощью примеров основных положений науки (химии) и философии ...
Химическая термодинамика
В данной главе мы познакомимся с основными законами и понятиями термодинамики.
термодинамическим началам
Первое начало термодинамики — закон сохранения энергии для термодинамических процессов. Он гласит:
Энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую.
химической энергией
тепловую энергию
Закон сохранения энергии для химических реакций гласит:
Тепловая энергия, выделившаяся в ходе химической реакции, равна изменению химической энергии.
Второе начало термодинамики имеет несколько различных, но в то же время эквивалентных формулировок.
1 — Постулат Клаузиуса . Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких-либо других изменений в системе . Это явление называют рассеиванием, или диссипацией, энергии.
2 — Постулат Кельвина . Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе .
Химические реакции с тепловым эффектом – это так называемые самопроизвольные процессы, то есть идущие сами по себе. К таким процессам относятся и экзотермические, и эндотермические реакции.
Однако после проведения ряда экспериментов было установлено, что существуют факторы, определяющие направление самопроизвольных реакций.
химические реакции идут самопроизвольно в сторону уменьшения энергии веществ.
Но многие реакции разложения (эндотермические по типу) тоже могут идти самопроизвольно, значит, уменьшение энергии – не единственный фактор.
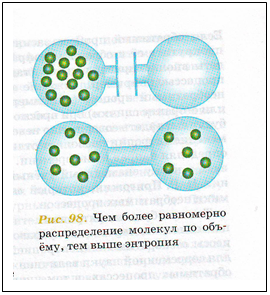 Оказывается, немаловажную роль играет также то, как энергия распределена в веществах – равномерно или собрана где-то в одном месте. Самопроизвольные процессы сопровождаются рассеиванием энергии и превращением ее в более неупорядоченную форму. Степень беспорядка характеризуется специальной величиной, которая называется энтропия .
Оказывается, немаловажную роль играет также то, как энергия распределена в веществах – равномерно или собрана где-то в одном месте. Самопроизвольные процессы сопровождаются рассеиванием энергии и превращением ее в более неупорядоченную форму. Степень беспорядка характеризуется специальной величиной, которая называется энтропия .
Энтропия (от греч. ξντροπία — поворот, превращение) – в естественных науках — мера беспорядка системы, состоящей из многих элементов.
Энтропия обозначается знаком S.
Рудольф Клаузиус впервые ввел это слово в термодинамике в 1865 году. В термодинамике оно означает меру необратимого рассеивания энергии, меру отклонения реального процесса от идеального.
Чем равномернее распределение всех свойств системы (энергии, давления, температуры и т. д.), тем больше энтропия. В направлении увеличения энтропии и происходят все самопроизвольные процессы.
Поэтому второе начало термодинамики в целом формулируется так:
В изолированных системах самопроизвольные процессы могут протекать только с увеличением энтропии. При обратимых процессах энтропия не изменяется.
Энтропия любой системы при абсолютном нуле температуры всегда может быть принята равной нулю
примечание к началам
Особенности обмена веществ и энергии у детей
... на интенсивность процессов обмена веществ у человека. При полном распаде в организме 1 г белков и 1 г углеводов выделяется по 4 ккал (16,747 кДж) энергии, 1 г ... в клетку из внешней среды пищевые вещества, резко отличающиеся от вещества клетки, в результате химических превращений становятся веществами клетки. Реакции расщепления. Сложные вещества распадаются на более простые, высокомолекулярные - ...
Нулевое начало термодинамики гласит:
Для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, которого она при фиксированных внешних условиях с течением времени самопроизвольно достигает.
При расчетах химических реакций химикам важно знать эти законы.
Термодинамика содержит множество формул, описывающих преобразования энергии в ходе химических реакций, и все они подчиняются основным законам, речь о которых шла в данной главе.
Тепловой эффект.
Ни одна химическая реакция не проходит без затрат или выделения определенного количества энергии или тепла. Это происходит оттого, что в каждом веществе изначально присутствует некое количество энергии. Причем в разных веществах это количество разное.
В ходе реакции происходит разрыв связей в исходных веществах и образование новых связей в продуктах реакции. Поскольку образование связи идет с выделением, а ее разрыв — с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами.
На основе разницы между запасом энергии в исходных веществах и продуктах реакции выделяют два типа реакций.
Первый тип – реакции с выделением тепла, или экзотермические (от греч. экзо – наружу) реакции. К нему относятся реакции, в которых запас энергии исходных веществ больше, чем запас энергии продуктов реакции. В таком случае энергия выделяется в окружающую среду, поэтому нужно организовать отвод тепла, чтобы избежать перегрева или взрыва химического реактора.
Реакции, в которых продукты имеют больший запас энергии, чем исходные вещества, относят ко второму типу – реакции с поглощением тепла, или эндотермические (от греч. эндо – внутрь).
В эндотермических реакциях необходимое тепло поглощается из окружающей среды, поэтому в лабораториях такие реакции происходят при нагревании.
Впервые термины «экзотермический» и «эндотермический» ввел французский химик Пьер Бертло , считающийся одним из основоположников термохимии [7] .
Примером экзотермических реакций могут служить реакции горения. Например, природный газ (метан CH 4 ) сгорает в кислороде воздуха с выделением большого количества теплоты:
CH 4 + 2O2 = CO2 + 2H2 O + 50,08 МДж
Также к экзотермическим относятся растворения металлов в кислотах, реакции нейтрализации и многие другие.
Примером эндотермической реакции является образование оксида углерода (II) CO и водорода H 2 из угля и воды, которое происходит только при нагревании:
C + H 2 O + 110 кДж
Таким образом, любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже — в виде световой или механической энергии).
Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для 1моль реагента или (реже) для 1 моль продукта реакции. Такая величина называется тепловым эффектом реакции.
Тепловой эффект
Тепловой эффект обозначается символом Q. Его величина соответствует разности между энергиями исходного и конечного состояний реакции.
В экзотермических реакциях Q > 0.
В эндотермических реакциях Q < 0.
тепловым эффектом
Уравнения, иллюстрирующие протекание химических реакций с тепловым эффектом, называются термохимическими. В этих уравнениях важно учитывать агрегатные состояния веществ, участвующих в реакции, и значение теплового эффекта в кДж.
Обозначение агрегатного состояния вещества имеет большое значение. Например, в реакции сгорания водорода первоначально образуется вода в виде пара (газообразное состояние), при конденсации которого может выделиться еще некоторое количество энергии. Следовательно, для образования воды в виде жидкости измеренный тепловой эффект реакции будет несколько больше, чем для образования только пара, поскольку при конденсации пара выделится еще порция теплоты.
Используется также частный случай теплового эффекта реакции — теплота сгорания. Из самого названия видно, что теплота сгорания служит для характеристики вещества, применяемого в качестве топлива. Теплоту сгорания относят к 1 моль вещества, являющегося топливом (восстановителем в реакции окисления), например:
C 2 H2 + 2,5O2 = 2CO2 + H2 O + 1300 кДж
где 1300 кДж – теплота сгорания ацетилена.
Если реакция обратима и может протекать в противоположных направлениях, то теплоты прямой и обратной реакций будут равны по абсолютной величине и противоположны по знаку.
Запасенную в молекулах энергию (Е) можно отложить на энергетической шкале. В этом случае тепловой эффект реакции (ΔЕ) можно показать графически.
|
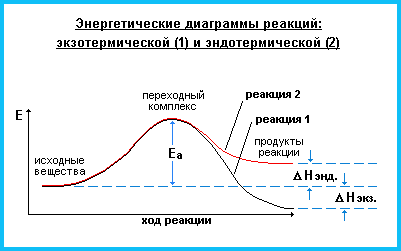
Тепловой эффект зависит не только от количества реагирующих веществ и продуктов реакции (прямая пропорциональная зависимость) и их природы, но и от внешних факторов, таких как температура и давление. При этом внешние факторы могут оставаться неизменными, тогда мы будем иметь дело с изобарными и изотермическими процессами.
Изотермический процесс, Изобарный процесс
Если реакция не сопровождается изменением объема, то тепловой эффект связан с изменением внутренней энергии Δ U:
ΔU = U продуктов – U реагентов
Изменение внутренней энергии противоположно тепловому эффекту:
ΔU = — Q
В таких реакциях теплота расходуется не только на изменение внутренней энергии веществ, но и на работу расширения/сжатия газов. Для расчета этой работы используется величина, которая называется энтальпия.
Энтальпия
H = U + pV,
где p — давление, V — объем.
В подобных случаях теплоту реакции выражают через изменение энтальпии:
ΔH = H продуктов – H реагентов
В экзотермических реакциях энтальпия уменьшается, в эндотермических, соответственно, увеличивается.
Изменение энтальпии равно тепловому эффекту по величине и противоположно по знаку:
ΔH = — Q
Знание тепловых эффектов химических реакций имеет большое практическое значение, как в химии, так и в других областях науки (например, физике и медицине).
Так при проектировании промышленного реактора необходимо знать, сколько тепловой энергии должно затрачиваться или будет выделяться в ходе реакции за единицу времени. В первом случае необходимо предусмотреть приток энергии для поддержания реакции, например путем подогрева реактора. Во втором случае, наоборот, необходимо эффективно отводить излишек теплоты, иначе произойдет перегрев реактора со всеми вытекающими отсюда последствиями, вплоть до взрыва.
Для расчета теплового эффекта реакции нужно знать законы науки, занимающейся непосредственно тепловым эффектом – термохимии.
Законы термохимии. , Термохимия
Основной закон термохимии сформулирован русским химиком Германом Гессом в 1840 году. Этот закон является частным случаем первого начала термодинамики (применительно к химическим реакциям)
Он гласит:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).
Этот закон можно проиллюстрировать на таком примере:
Процесс окисления глюкозы в организме осуществляется по сложному многостадийному механизму:
С 6 Н 12 О 6 + 2АДФ + 2 Н 3 РО 4 + 2НАД = 2С 3 Н 4 О 3 + 2НАД·2Н 2 + 2АТФ + 2Н 2 О
2С 3 Н 4 О 3 + 6О 2 + 36АДФ + 36Н 3 РО 4 + 2НАДФ·Н 2 = 6СО 2 + 42Н 2 О + 36АТФ+2НАД
Однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы:
C6 H12 O6 +6О2 =6СО2 + 6Н2 О+ Q
ΔH ( C 6 H 12 O 6 ) = 2815800 кДж / кмоль
Очень важны следствия из закона:
1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа ).
2. Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν).
3. Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν).
Здесь следует рассказать подробнее о теплоте образования.
Теплота образования химического вещества, Теплота сгорания
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т.н. стандартным условиям.
Стандартные условия
Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю.
Важность закона Гесса состоит в том, что можно просчитать тепловой эффект практически любой химической реакции, несмотря на то, как протекает реакция.
§2. Экспериментальное определение теплового эффекта
Знание теплового эффекта позволяет рассчитать теплоту любой реакции, даже совершенно невозможной. Так, алмаз при обычных условиях никогда не превращается в графит, но тепловой эффект этой реакции нам известен, он составляет 1,9 кДж/моль. Для расчета теплового эффекта достаточно знать энергии реагентов и продуктов, а проводить эксперимент совершенно необязательно.
На основании законов термодинамики, для измерения теплового эффекта вещества был создан специальный прибор – калориметр.
Калориметр, Схема устройства простейшего калориметра:
1 — внешний сосуд;
2 — термометр;
3 — калориметрический стакан;
4 — мешалка;
5 — вода;
6 — пробирка с веществом, закрытая пробкой.
В данном калориметре идет реакция гидролиза, т. е. растворения соли в воде и реакции обмена между ними.
Изменение теплоты веществ, находящихся внутри реактора, повышает или понижает его температуру. Все изменения температуры регистрируются с помощьютермометра. Простейший калориметр – это сосуд с калориметрической жидкостью, помещенной в оболочку с малой теплопроводностью. Зная теплоемкость калориметра и точно измерив изменение температуры жидкости, можно узнать теплоту процесса, проходящего в калориметре. (При этом важно, чтобы теплота передавалась калориметру или отнималась от него очень быстро, а также учитывать возможность теплообмена с окружающей средой).
Калориметры бывают 2 типов:
- С постоянной температурой.
Оболочка состоит из плавящегося твердого тела или испаряющегося жидкого. Температура остается постоянной, так как вся выделившаяся или поглощенная теплота идет на изменение АС вещества. В таком случае о тепловом эффекте судят по количеству изменившего свое состояние вещества. Такие калориметры обычно используются, если реакция экзотермическая.
- С переменной температурой.
Существует два вида таких калориметров:
- Адиабатический. Во время протекания реакции температуру изменяют так, чтобы она постоянно совпадала с температурой реактора. Тогда изменения температуры не происходит, значит, систему можно считать изолированной.
- Диатермический. Закрытая система реактора обменивается теплотой с оболочкой, а в оболочке содержится много воды (вода обладает большой теплоемкостью, поэтому ее температура почти не изменяется).
В таком случае теплообмен рассчитывается специальными методами.
Именно калориметры последнего типа используются в большинстве реакций со значительным тепловым эффектом. В случае если нужно измерить Q реакции горения, используют калометрическую бомбу, предложенную М. Бертло.
В калометрической бомбе испытуемое соединение сгорает в кислороде при постоянном объеме, под высоким давлением около 20-30 атмосфер. В таком случае происходит полное сгорание вещества.
Калометрическая бомба состоит из толстостенного цилиндра с помещенной внутрь него чашечкой с веществом, над которой помещают тонкую железную проволочную спираль. По спирали пропускают ток, она сгорает, раскаленная окалина поджигает вещество. При известных H сгорания исходных веществ, рассчитать Q реакции сравнительно легко.
Для учета теплообмена калориметра с окружающей средой и определения истинного изменения температуры во время опыта весь калориметрический процесс делятся на три периода:
Очень важно помнить о возможных ошибках и неточностях расчета, связанных в основном с теплообменом с окружающей средой. Во избежание ошибок, нужно проводить реакции как можно быстрее и поддерживать постоянную температуру воздуха в лаборатории.
§3. Применение теплового эффекта на практике
Тепловые эффекты химических реакций нужны для многих технических расчетов.
Зная тепловой эффект и законы термохимии, можно рассчитать, будет ли протекать реакция, не ставя практических экспериментов.
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей — спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы — калории (1 кал = 4,1868 Дж).
Энергетическое содержание пищи относят к какой-нибудь массе пищевых продуктов: к 1 г, к 100 г или даже к стандартной упаковке продукта. Например, на этикетке банки со сгущенным молоком можно прочитать такую надпись: «калорийность 320 ккал/100 г».
Химические «грелки» и охлаждающие пакеты
Известно несколько видов «обыкновенных химических грелок».
Устройство их очень простое: обычно это два пакета (маленький и большой) из водонепроницаемого и химически стойкого материала (пленки, ткани).
Внутри маленького пакета — вещество или смесь веществ. Чтобы грелка начала работать, сюда надо добавить немного воды и перемешать содержимое пакета. Потом пакет закрывают, вставляют в большой и еще раз тщательно закупоривают; теперь грелкой можно пользоваться. Одна из самых простых химических грелок содержит оксид кальция СаО (негашеную известь), который взаимодействует с водой с образованием гидроксида кальция:
СаО + Н 2 О = Са(ОН)2 +
Реакция сопровождается тепловыделением. Температура грелки может достигать 70—80° С. В химической грелке другого вида используют взаимодействие металлов (в виде стружки) и солей.
Совершенно сухую смесь железной (Fe) или алюминиевой (А1) стружки с солями меди (например, СuС1 2 ) можно хранить довольно долго, а при добавлении воды температура сразу же повышается почти до 100°С за счет реакции:
Fe + CuCl 2 = FeCl2 + Cu.
При этом грелка, в которой хлорид меди СuС1 2 превращается в хлорид железа FeCl2 , сохраняет тепло около десяти часов.
Примерно по тому же принципу работают противоположные грелкам устройства – гипотермические, или охлаждающие, пакеты. Их главное отличие от грелок состоит в том, что в них происходят эндотермические реакции.
В гипотермических пакетах происходит гидролиз аммиачной селитры (NH 4 NO3 ), происходящий с поглощением тепла. Принцип действия охлаждающего пакета прост: если раздавить ампулу с водой внутри пакета, вода вступает в химическую реакцию с аммиачной селитрой, поглощая энергию из окружающей среды, т.е. охлаждая её.
NH4 NO3 + H2 O = NH4 OH + HNO3 — 23.1кДж /моль
Гипотермические пакеты широко используются в медицине и в быту.
Жаропрочные покрытия
Развитие техники высоких температур вызывает необходимость создания особо жаропрочных материалов. Эта задача может быть решена путём использования тугоплавких и жаропрочных металлов. Интерметаллические покрытия привлекают всё большее внимание, поскольку обладают многими ценными качествами: стойкостью к окислению, агрессивными расплавами, жаропрочностью и т.д. Интерес представляет и существенная экзотермичность образования этих соединений из составляющих их элементов. Возможны два способа использования экзотермичности реакции образования интерметаллидов. Первый – получение композитных, двухслойных порошков. При нагреве компоненты порошка вступают во взаимодействие, и тепло экзотермической реакции компенсируют остывание частиц, достигающих защищаемой поверхности в полностью расплавленном состоянии и образующих малопористое прочно сцеплённое с основой покрытие. Другим вариантом может быть нанесение механической смеси порошков. При достаточном нагреве частиц они вступают во взаимодействие уже в слое покрытие. Если величина теплового эффекта значительная, то это может привести к самопроплавлению слоя покрытия, образованию промежуточного диффузионного слоя, повышающего прочность сцепления, получения плотной, малопористой структуры покрытия. При выборе композиции, образующей интерметаллидное покрытие с большим тепловым эффектом и обладающее многими ценными качествами – коррозионной стойкостью, достаточной жаропрочностью и износостойкостью, обращает на себя внимание алюминиды никеля, в частности NiAl и Ni 3 Al. Образование NiAl сопровождается максимальным тепловым эффектом.
Термохимический способ обработки алмаза
Свое название «термохимический» способ получил благодаря тому, что протекает он при повышенных температурах, а в основе его лежит использование химических свойств алмаза. Осуществляется способ следующим образом: алмаз приводят в контакт с металлом, способным растворять в себе углерод, а для того, чтобы процесс растворения или обработки шел непрерывно, его проводят в атмосфере газа, взаимодействующего с растворенным в металле углеродом, но не реагирующим непосредственно с алмазом. В процессе обработки алмаза величина теплового эффекта имеет особое значение.
Для определения оптимальных условий проведения термохимической обработки алмаза и выявления возможностей способа потребовалось изучить механизмы определенных химических процессов, которые, как показал анализ литературы, вообще не исследовались. Более конкретному изучению термохимической обработки алмаза мешало, прежде всего, недостаточное знание свойств самого алмаза. Опасались испортить его нагревом. Исследования по термической устойчивости алмаза были выполнены лишь в последние десятилетия. Установлено, что алмазы, не содержащие включений, в нейтральной атмосфере или в вакууме можно без всякого для них вреда нагреть до 1850°С и выше.
Алмаз является лучшим материалом для лезвия благодаря уникальной твердости, упругости и низкому трению по биологическим тканям. Оперирование алмазными ножами облегчает проведение операций, сокращает в 2-3 раза сроки заживления разрезов. По мнению микрохирургов МНТК микрохирургии глаза, ножи, заточенные термохимическим способом, не только не уступают, но и превосходят по качеству лучшие зарубежные образцы. Термохимически заточенными ножами уже сделаны тысячи операций. Алмазные ножи разной конфигурации и размеров могут применяться и в других областях медицины, биологии. Так, для изготовления препаратов в электронной микроскопии используют микротомы. Высокая разрешающая способность электронного микроскопа предъявляет особые требования к толщине и качеству среза препаратов. Алмазные микротомы, заточенные термохимическим методом, позволяют изготавливать срезы нужного качества.
Заключение.
Каждое тело в нашем мире имеет определенное количество энергии, постоянно приобретаемой и расходуемой им в результате взаимодействия с окружающей средой. При этом энергия часто переходит в другую форму. Изучением превращений энергии занимается наука термодинамика. Мы познакомились с основными понятиями термодинамики и началами, которым она подчиняется.
В современной жизни человека не обойтись без химии. Одним из разделов этой науки является термохимия, изучающая химические реакции с тепловым эффектом. Зная законы термохимии, мы можем судить о возможности протекания той или иной реакции при определенных условиях, и ее результатах даже не прибегая к практическому опыту. Мы рассмотрели основной закон термохимии и следствия из него.
Знание тепловых эффектов реакций также необходимо для расчетов тепловых балансов технологических процессов. Теплоты сгорания применяют при подборе оптимального топлива, расчетах удельной тяги ракетных двигателей, оценке калорийности продуктов. В практической термодинамике тепловые эффекты реакций используют для расчета температурной зависимости констант равновесия, энтропийных эффектов химических реакций, при исследованиях кислотно-основных взаимодействий. С помощью тепловых эффектов реакций определяют энергии химических связей, рассчитывают термодинамические функции образования молекул и ионов в различных состояниях.
В условиях развития современных технологий теплой эффект нашел свое применение в различных отраслях. Медицина и биотехнология, военная, строительная, пищевая, горнодобывающая и многие другие отрасли используют тепловой эффект химических реакций. Он применяется в двигателях внутреннего сгорания и в различных топочных устройствах, а также в производстве хирургических приборов, жаропрочных покрытий, изготовлении новых видов строительных материалов и так далее.
Мы разносторонне рассмотрели понятие теплового эффекта и его значение для химии, а также некоторые варианты его использования в условиях развития современных технологий.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ:
[Электронный ресурс]//URL: https://psychoexpert.ru/referat/zavisimost-teplovogo-effekta-ot-temperaturyi/
1. Большая Советская Энциклопедия. Электронный вариант.
2. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. – М.: Мир, 1982 – Т.1,2.
3. Егоров А.С. Химия. Современный курс. Ростов нв Дону: Феникс. 2011 г. 699с.
4. Еремин В. В., Кузьменко Н. Е., Лунин В. В., Дроздов А. А., Теренин В. И. Химия 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений / под ред. Н. Е. Кузьменко, В. В. Лунина. – М.: Дрофа, 2010. – 462,[2]с
5. Еремин Е.Н. Основы химической термодинамики. Изд. 2-ое. 1978. — 392 с
6. Кузьменко Н.Е., Еремин В. В., Попков В.А. Химия для поступающих в ВУЗы. М.: МГУ. 2008 г.
7. Леенсон И. А. Химические реакции: Тепловой эффект, равновесие, скорость. — М.: ООО «Издательство Астрель», 2002.
8. Материалы с сайта http://chemistry.ru
9. Материалы с сайта http://www.hemi.nsu.ru/ucheb211.htm
10. Материалы с сайта .
11. Перегудов В.В., Роговой М.И. Тепловые процессы и установки в технологии строительных изделий и деталей.– М.:Стройиздат,1983.-416с.
12. Третьяков Ю.Д. Неорганическая химия: физико-химические основы неорганической химии. – М..: Академия, 2004
13. Мануйлов А. В., Родионов В. И. Основы химии. Электронный учебник.
14. Энциклопедия для детей, т.17. Химия. – М: Аванта+, 2003
http://www.krugosvet.ru/enc/nauka_i_tehnika/tehnologiya_i_promyshlennost/TERMODINAMIKA.html Данные соответствуют 27.03.2011
В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин, А. А. Дроздов, В. И. Теренин Химия 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений / под ред. Н. Е. Кузьменко, В. В. Лунина. – М.: Дрофа, 2010. – 462,[2]с. – стр. 229.
Рудольф Юлиус Эммануель Клаузиус (1822 — 1888) — немецкий физик и математик.
Уильям Томсон, лорд Кельвин (1824 – 1907) – великий английский физик.
В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин, А. А. Дроздов, В. И. Теренин Химия 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений / под ред. Н. Е. Кузьменко, В. В. Лунина. – М.: Дрофа, 2010. – 462,[2]с. – стр. 241.
Бертло (Бертело) — французский химик и общественный деятель.
Профессор химии Высшей фармацевтической школы в Париже (1859 г.) и Коллеж де Франс (1864 г.), член Парижской АН (1873 г.) и её непременный секретарь (1889 г.), член-корреспондент Петербургской АН (1876 г.).
Министр просвещения (1886-87 гг.) и иностранных дел (1895 г.).
Автор многочисленных работ по органической химии, термохимии, агрохимии, истории химии и др.
http://www.alhimik.ru/great/berthelot.html , данные соответствуют 08. 04.2011
, данные соответствуют 14.04.11
http://www.xiron.ru/content/view/23194/28/, данные соответствуют 14.04.11
[10] В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин, А. А. Дроздов, В. И. Теренин . Указ. Пособие – стр. 230-231
http://dic.academic.ru/dic.nsf/ntes/4783/ТЕРМОХИМИЯ, данные соответствуют 14.04.11
Русский химик Герман Иванович (Герман Генрих) Гесс (1802 – 1850 гг.) – известен как основатель термохимии, им сформулирован основной закон термохимии – «закон постоянства сумм теплот».
festival.1september.ru/articles/565598/pril1.ppt, данные соответствуют 14.04.11
Антуан Лоран Лавуазье (1743 — 1794), французский химик, один из основателей термохимии. Он первым пришел к выводу, что теплота разложения соединения равна теплоте его образования и определил теплоты горения ряда веществ.
, данные соответствуют 08.04.2011
В. В. Еремин, Н. Е. Кузьменко, В. В. Лунин, А. А. Дроздов, В. И. Теренин Химия 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений / под ред. Н. Е. Кузьменко, В. В. Лунина. – М.: Дрофа, 2010. – 462,[2]с. – стр. 232.
http://bse.sci-lib.com/article058017.html , данные соответствуют 20.04.11
, данные соответствуют 20.04.11
http://zhurnal.lib.ru/l/lepetow_d_w/chemistry.shtml, данные соответствуют 13.04.2011
