Если в сосуд с водой поместить кристаллы поваренной соли, сахара или перманганата калия (марганцовки), то мы можем наблюдать, как количество твердого вещества постепенно уменьшается. При этом вода, в которую были добавлены кристаллы, приобретает новые свойства: у нее появляется соленый или сладкий вкус (в случае марганцовки появляется малиновая окраска), изменяется плотность, температура замерзания и т.д. Полученные жидкости уже нельзя назвать водой, даже если они неотличимы от воды по внешнему виду (как в случае с солью и сахаром).
Это – растворы .
Растворы — однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
молекулярные
По агрегатному состоянию растворы могут быть жидкими (морская вода) , газообразными (воздух) или твёрдыми (многие сплавы металлов).
Размеры частиц в истинных растворах — менее 10 -9 м (порядка размеров молекул).
Любой раствор состоит из растворителя и растворенного вещества . В приведенных примерах растворителем является вода. Но не всегда обязательно вода является растворителем. Например, можно получить раствор воды в серной кислоте. Здесь растворителем будет кислота. Можно приготовить и растворы кислоты в воде.
Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом.
** Существуют растворы не только жидкие, но и газовые и даже твердые. Например, воздух – раствор кислорода и еще нескольких газов в азоте. Сплавы металлов представляют собой твердые растворы металлов друг в друге. Газы, как мы уже знаем, способны растворяться в воде.
Давайте разберемся в том, как происходит растворение веществ. Для этого понаблюдаем, как растворяется добавленный в чай сахар. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро.
Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют с молекулами воды донорно-акцепторные (водородные) связи. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя (рис. 7-2).
Реферат для детей вода
... воды особенно важны способность её молекул дисоциировать (распадаться) на ионы и способность воды растворять вещества разной химической природы. Роль воды, как главного и универсального растворителя определяется прежде всего полярностью её молекул ...
 Рис. 7-2. Молекулы сахара (белые кружочки), находящиеся на поверхности кристалла сахара, окружены молекулами воды (темные кружочки).
Рис. 7-2. Молекулы сахара (белые кружочки), находящиеся на поверхности кристалла сахара, окружены молекулами воды (темные кружочки).
Между молекулами сахара и воды возникают водородные связи, благодаря которым молекулы сахара отрываются от поверхности кристалла. Молекулы воды, не связанные с молекулами сахара, на рисунке не показаны.
диффузией
Они мешают новым молекулам воды подойти к поверхности кристалла, чтобы связаться с его молекулами водородными связями. Если раствор перемешивать, то диффузия происходит интенсивнее и растворение сахара идет быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему.
Количество молекул, способных перейти в раствор, часто ограничено. Молекулы вещества не только покидают кристалл, но и вновь присоединяются к кристаллу из раствора. Пока кристаллов относительно немного, больше молекул переходит в раствор, чем возвращается из него – идет растворение. Но если растворитель находится в контакте с большим количеством кристаллов, то число уходящих и возвращающихся молекул становится одинаковым и для внешнего наблюдателя растворение прекращается.
Ненасыщенные, насыщенные и перенасыщенные растворы
Если молекулярные или ионные частицы, распределённые в жидком растворе присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества, раствор называется насыщенным. (Например, если поместить 50 гNaCl в 100 г H 2 O, то при 20ºC растворится только 36 г соли).
Насыщенным
Поместив в 100 г воды при 20ºC меньше 36 г NaCl мы получим ненасыщенный раствор .
При нагревании смеси соли с водой до 100C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 20ºC, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором . Перенасыщенные растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
Ненасыщенный раствор, Перенасыщенный раствор, Растворение как физико-химический процесс
Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода — гидратацией ).
Растворение протекает с образованием различных по форме и прочности продуктов — гидратов. При этом участвуют силы как физической, так и химической природы. Процесс растворения вследствие такого рода взаимодействий компонентов сопровождается различными тепловыми явлениями.
Энергетической характеристикой растворения является теплота образования раствора , рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо- и экзотермических стадий процесса. Наиболее значительными среди них являются:
- поглощающие тепло процессы — разрушение кристаллической решётки, разрывы химических связей в молекулах;
- выделяющие тепло процессы — образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание).
Так, растворение NaOH – экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na + и OH— выделяется соответственно 422 и 510кДж/моль.
Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH 4 NO3 наблюдается понижение температуры).
Растворимость
растворимость
Растворимостью –
Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым . Если растворяется менее 1 г вещества – вещество малорастворимо . Наконец, вещество считают практически нерастворимым , если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не бывает.
Растворимость, выраженная при помощи массы вещества, которое может раствориться в 100 г воды при данной температуре, называют также коэффициентом растворимости.
В качестве примера приведем растворимость (в граммах вещества на 100 г воды при комнатной температуре) нескольких веществ: твердых, жидких и газообразных, среди которых многие имеют похожие химические формулы (таблица 7-2).
Таблица 7- 2. Растворимость некоторых веществ в воде при комнатной температуре, растворимость большинства (но не всех!) твердых веществ с увеличением температуры увеличивается, а растворимость газов, наоборот, уменьшается. Это связано прежде всего с тем, что молекулы газов при тепловом движении способны покидать раствор гораздо легче, чем молекулы твердых веществ.
**Если измерять растворимость веществ при разных температурах, то обнаружится, что одни вещества заметно меняют свою растворимость в зависимости от температуры, другие – не очень сильно (см. табл. 7-3).
| Название вещества | Формула | Агрегатное состояние | Растворимость (г/100 г воды) |
| Серная кислота | H 2 SO4 | жидкость | любое количество |
| Хлористый водород | HCl | газ | 71,9 |
| Хлорид натрия | NaCl | кристал. | 35,9 |
| Сульфат меди | CuSO 4 5H2 O | кристал. | 20,7 |
| Сульфат кальция | CaSO 4 | кристал. | 0,2 |
| Тетрахлорид углерода | CCl 4 | жидкость | 0,08 |
| Сульфат бария | BaSO 4 | кристал. | 0,00023 |
| Хлорид серебра | AgCl | кристал. | 0,00015 |
Если полученные в опытах значения нанести на оси координат, то получаются так называемые кривые растворимости различных веществ (рис. 7-3).
Эти кривые имеют практическое значение. По ним легко узнать, сколько вещества (например, KNO 3 ) выпадет в осадок при охлаждении до 20 С насыщенного раствора, приготовленного при 80 С.
| . Вещество | Температура, ° C | ||||
| 0 | 20 | 50 | 80 | 100 | |
| KBr | 53,5 | 65,2 | 80,8 | 94,6 | 103,3 |
| NaCl | 35,7 | 35,9 | 36,8 | 38,1 | 39,4 |
| CaSO 4 | 0,176 | 0,206 | 0,180 | 0,102 | 0,066 |
Таблица 7-3. Влияние температуры на растворимость некоторых твердых веществ. В таблице приведена растворимость в г/100 г воды
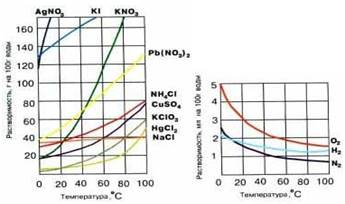
Рис. 7-3. Кривые растворимости твердых (а) и газообразных (б) веществ.
насыщенный по основному веществу
ПЕРЕКРИСТАЛЛИЗАЦИЕЙ
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях).
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.
Природа растворяемого вещества
P — хорошо растворимые (более 1,0 г на 100 г воды);
M — малорастворимые (0,1 г — 1,0 г на 100 г воды);
Н — нерастворимые (менее 0,1 г на 100 г воды).
(Смотри таблицу растворимости)
Природа растворителя, Влияние температуры
Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается.
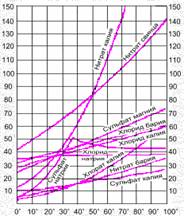
Влияние давления
Способы выражения концентрации растворов
Существуют различные способы выражения состава раствора. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества
w (B) = m(B) / m
Молярная концентрация
C (B) = n(B) / V = m(B) / (M(B)
- V),
где М ( B ) — молярная масса растворенного вещества г/моль.
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Нормальность
Грамм — эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ — это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Э основания = Моснования / число замещаемых в реакции гидроксильных групп
Э кислоты = Мкислоты / число замещаемых в реакции атомов водорода
Э соли = Мсоли / произведение числа катионов на его заряд
Величины нормальности обозначают буквой «Н». Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H 2 SO4 «. Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2 SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4 , и двухнормальным в реакции с образованием Na2 SO4 .
Пересчет концентраций растворов из одних единиц в другие
При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная — на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с — процентная концентрация; M — молярная концентрация; N — нормальная концентрация; э — эквивалентная масса, — плотность раствора; m — мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (c
- p
- 10) / m
N = (c
- p
- 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (N
- Э) / m
N = (M
- m) / Э
| Растворимость твердых веществ |
Растворимость веществ, являющихся твердыми при температуре растворения, выражена через массовый коэффициент растворимости k (в граммах безводного вещества на 100 г воды).
Как правило, растворимость приведена в холодной (20 °С) и горячей воде (80 С), иная температура указана верхним индексом, причем значок * отвечает интервалу комнатной температуры (18-25° С).
Прочерк отвечает полному разложению вещества водой. Многоточие означает отсутствие данных.
| Вещество | k , 20° | k , 80° | Вещество | k , 20° | k , 80° |
| AgF | 172 | 216 | KNO 2 | 306,7 | 376 |
| AgNO 3 | 227,9 | 635,3 | KNO 3 | 31,6 | 168,8 |
| AlCl 3 | 45,9 | 48,6 | KOH | 112,4 | 162,5 |
| Al 2 (SO4 )3 | 36,4 | 73,1 | K 3 PO4 | 98,5 | 178,5 60 |
| B(OH) 3 | 4,87 | 23,54 | K 2 SO3 | 107,0 | 111,5 |
| BaCl 2 | 36,2 | 52,2 | K 2 SO4 | 11,1 | 21,4 |
| Ba(OH) 2 | 3,89 | 101,4 | K 2 S2 O6 (O2 ) | 4,7 | 11,0 40 |
| BaS | 7,86 | 49,91 | LiCl | 84,5 25 | 112,3 |
| BeCl 2 | 72,8 | 77,0 30 | LiOH | 12,8 | 15,3 |
| BeSO 4 | 39,1 | 67,2 | Li 2 SO4 | 34,7 | 31,9 75 |
| CaCN 2 | 2,50 25 | — | MgCl 2 | 54,8 | 65,8 |
| CaCl 2 | 74,5 | 147,0 | MgSO 4 | 35,1 | 54,8 |
| Ca(ClO) 2 | 33,3 25 | — | MnCl 2 | 73,9 | 112,7 |
| Ca(NO 3 )2 | 129,3 | 358,7 | MnSO 4 | 62,9 | 45,6 |
| CdCl 2 | 113,4 | 140,4 | (NH 4 )2 CO3 | 100 15 | — |
| CdSO 4 | 76,4 | 67,2 | NH 4 Cl | 37,2 | 65,6 |
| CrCl 3 | 34,9 25 | — | N 2 H5 Cl | 179 25 | … |
| Cr 2 (SO4 )3 | 64 25 | … | NH 4 F | 82,6 | 117,6 |
| CsCl | 186,5 | 250 | NH 4 HCO3 | 21,7 | — |
| CsOH | 385,6 15 | 303 30 | NH 4 HS | 128,1 0 | — |
| CuCl 2 | 72,7 | 96,1 | NH 4 NCS | 170 | 431 |
| CuSO 4 | 20,5 | 55,5 | NH 4 NO3 | 192,0 | 580,0 |
| FeCl 2 | 68 | 90,7 | (NH 3 OH)Cl | 83 | 194 |
| FeCl 3 | 91,9 | — | (NH 4 )2 SO4 | 75,4 | 94,1 |
| Fe(NH 4 )2 (SO4 )2 | 26,4 | 52 70 | Na 2 B4 O7 | 2,5 | 24,3 |
| FeSO 4 | 26,6 | 43,7 | Na 2 CO3 | 21,8 | 45,1 |
| Fe 2 (SO4 )3 | 440* | — | NaCl | 35,.9 | 38,1 |
| H 2 C2 O4 | 9,52 | 84,5 | NaClO | 53,4 | 129,9 50 |
| H 2 (PHO3 ) | 694 30 | … | NaClO 2 | 64 | 122 60 |
| H 3 PO4 | 548 | … | NaClO 3 | 95,9 | 203,9 100 |
| H 2 SeO4 | 566,6 | 2753 50 | NaClO 4 | 211 25 | 300 75 |
| H 6 TeO6 | 50,05 30 | 106,4 | NaHCO 3 | 9,59 | 20,2 |
| HgCl | 6,59 | 24,2 | NaH 2 PO4 | 85,2 | 207,3 |
| K[Ag(CN) 2 ] | 25 | 100 | Na 2 HPO4 | 7,66 0 | 92,4 |
| KAl(SO 4 )2 | 5,9 | 71,0 | NaHSO 4 | 28,6 | 50 100 |
| K[Au(CN) 2 ] | 14* | 200 | NaNO 2 | 82,9 | 135,5 |
| KBr | 65,2 | 94,6 | NaNO 3 | 87,6 | 149 |
| KBrO 3 | 6,87 | 34,28 | NaOH | 108,7 | 314 |
| KCN | 69,9 | 99,8 | Na(PH 2 O2 ) | 83 25 | 554 100 |
| K 2 CO3 | 111,0 | 139,2 | Na 2 (PHO3 ) | 419 0 | … |
| KCl | 34,4 | 51,1 | Na 3 PO4 | 14,5 25 | 68,0 |
| KClO 3 | 7,3 | 37,6 | Na 2 S | 18,6 | 49,2 |
| K 2 CrO4 | 63,0 | 75,1 | Na 2 SO3 | 26,1 | 29,0 |
| K 2 Cr2 O7 | 12,48 | 73,01 | Na 2 SO4 | 19,2 | 43,3 |
| KCr(SO 4 )2 | 12,51 25 | … | Na 2 (SO3 S) | 70,1 | 229 |
| KF | 94,93 | 150,1 | NiCl 2 | 64,0 | 86,2 75 |
| K 3 [Fe(CN)6 ] | 46,0 | 81,8 | NiSO 4 | 38,4 | 66,7 |
| K 4 [Fe(CN)6 ] | 28,0 | 67,0 | Pb(NO 3 )2 | 52,2 | 107,4 |
| KHCO 3 | 33,3 | 68,3 70 | RbCl | 91,1 | 127,2 |
| K(HF 2 ) | 39,2 | 114 | RbOH | 179 15 | 282 47 |
| KH 2 PO4 | 22,6 | 70,4 | SnCl 2 | 269,8 15 | — |
| K 2 HPO4 | 159,8 | 267,5 63 | SnSO 4 | 18,8 19 | — |
| KI | 144,5 | 190,7 | SrCl 2 | 53,1 | 93,1 |
| KIO 3 | 8,1 | 24,8 | TlNO 3 | 9,55 | 111 |
| KMnO 4 | 6,36 | 25 65 | TlOH | 34,3 18 | 126,1 90 |
| KCN | 69,9 | 99,8 | ZnCl 2 | 367 | 549 |
| KNCS | 217 | 408 67 | ZnSO 4 | 54,1 | 67,2 |
Дисперсные и коллоидные системы. Растворы , Дисперсные системы.
дисперсную фазу
К дисперсным системам относятся
истинные растворы
Суспензии
Эмульсии
Коллоидные системы. Коллоидные растворы
Коллоидные растворы иначе называют золями. Их получают дисперсионными и конденсационными методами. Диспергирование чаще всего производят при помощи особых “коллоидных мельниц”. При конденсационном методе коллоидные частицы образуютсяза счет объединения атомов или молекул в агрегаты. Так, если возбудить в воде дуговой электрический разряд между двумя проволоками из серебра, то пары металла конденсируются в коллоидные частицы. При протекании многих химических реакций также происходит конденсация и образуются высокодисперсные системы (выпадение осадков, протекание гидролиза, окислительно-восстановительные реакции и т.д.).
Золи обладают рядом специфических свойств, которые подробно изучает
эффект Тиндаля
частицы имеют электрические заряды одного знака.
коагуляцией
Обычно коагуляция происходит при прибавлении к золю: 1) электролита,2) другого золя, частицы которого имеют противоположный заряд, и 3) при нагревании.
При определенных условиях коагуляция золей приводит к образованию студенистой массы, называемой гелем. В этом случае вся масса коллоидных частиц, связывая растворитель, переходит в своеобразное полужидкое-полутвердое состояние. От гелей следует отличать студни — растворы высокомолекулярных веществ в низкомолекулярных жидкостях (системы гомогенные). Их можно получить при набухании твердых полимеров в определенных жидкостях.
Значение золей исключительно велико, так как они более распространены, чем истинные растворы. Протоплазма живых клеток, кровь, соки растений — все это сложные золи. С золями связано получение искусственных волокон, дубление кож, крашение, изготовление клеев, лаков, пленок, чернил. Много золей в почве, и они имеют первостепенное значение для ее плодородия.
Растворы. Растворами называются гомогенные (однородные) системы, содержащие не менее двух веществ. Т. е. могут существовать растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость.
Механизм образования растворов.
экзотермический процесс
сольватами
Сольваты (гидраты) образуются за счет донорно-акцепторного, ион-дипольного взаимодействия, за счет водородных связей, а также дисперсионного взаимодействия (в случае растворов родственных веществ, например бензола и толуола).
Особенно склонны к гидратации (соединению с водой) ионы. Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы. Поэтому, например, в растворе ион меди (II) голубой, в безводном сульфате меди он бесцветный. Многие из таких соединений непрочны и легко разлагаются при выделении их в свободном виде, однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора кристаллизацией. При этом выпадают кристаллы, содержащие молекулы воды.
кристаллогидратами,
Таким образом, растворение — не только физический, но и химический процесс. Растворы образуются путем взаимодействия частиц растворенного вещества с частицами растворителя.
Растворимость веществ.
Примером малорастворимых в воде веществ могут служить гипс, сульфат свинца (твердые вещества), диэтиловый эфир, бензол (жидкие вещества), метан, азот, кислород (газообразные вещества).
Многие вещества в воде растворяются весьма хорошо. Примером таких веществ могут служить сахар, медный купорос, гидроксид натрия (твердые вещества), спирт, ацетон (жидкие вещества), хлороводород, аммиак (газообразные вещества).
Из приведенных примеров следует, что растворимость прежде всего зависит от природы веществ. Кроме того, она зависит также от температуры и давления. Сам процесс растворения обусловлен взаимодействием частиц растворимого вещества и растворителя; это самопроизвольный процесс.
насыщенные, ненасыщенные
Раствор, в котором данное вещество при данной температуре больше не растворяется, т. е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.
