| :: поиск :: подписка :: издатели :: карта сайта | |
| Том 09/N 1/2007 | ОКНО В МИР |
A.Wirz-Justice, Франция
В обзоре обсуждается важный вопрос о значении расстройств циркадианного (циркадный) ритма при депрессии. Предлагается к рассмотрению модель понимания роли этих нарушений, а также анализ современного состояния проблемы и данных по применению хронобиологических методов терапии.
Клинические и экспериментальные данные по биологическим ритмам при депрессии, уже освещавшиеся в предыдущей публикации [19], подробно не рассматривают. В основе работ в области хронобиологии лежит аксиома: распорядок активности необходим для здоровья. Психологические, поведенческие, физиологические и гормональные ритмы подчиняются специфическому и функциональному ритму (регулируемому, или синхронизируемому), который соотносится со сном и циклом день-ночь. Предпосылкой к анализу явилось предположение о том, что расстройства ритма должны иметь свои клинические корреляты. Циклические закономерности аффективных расстройств хорошо известны с древнейших времен. Однако до сих пор неясно, насколько тесно связаны циркадианные ритмы с психопатологическими проявлениями, могут ли они объяснить механизмы развития аффективных расстройств и как их следует понимать в аспекте нейротрансмиттерных моделей депрессии. Первый из этих вопросов рассматривается во всех клинических исследованиях: что мы имеем в виду под биологически гомогенными группами? Не менее важен этот вопрос и для диагностики аффективных расстройств. Наряду с дифференциацией на униполярное, биполярное и сезонное аффективное расстройство (САР) стадия заболевания также может иметь значение для оценки хронобиологических расстройств.
Учитывая действие антидепрессантов на нейротрансмиттерные механизмы, также участвующие в генерации и регуляции циркадианного ритма, только у нелеченых пациентов можно наблюдать истинные «эндогенные» нарушения ритма, если таковые имеют место. Второй вопрос касается концептуального уточнения: что мы имеем в виду, когда говорим о нарушениях ритма при депрессии? То, что мы наблюдаем в клинике, может быть связано с нарушениями на разных уровнях — не обязательно непосредственно с патологическими изменениями в гипоталамических биологических часах, но также и с эпифеноменами, сопряженными с нарушениями ритма поведения, расстройствами сна или аномальными стимулами из окружающей среды.
Третий вопрос касается адекватности методологии предыдущих исследований расстройств циркадианного ритма при депрессии. К сожалению, большинство этих исследований имеет методологические недостатки не в плане их научного масштаба или целей, а в связи с тем, что в то время, когда они проводились, еще не было известно, в какой степени «маски» депрессии (поведенческие или средовые факторы, искажающие оцениваемые показатели) способны скрывать сопряженные с аффективными расстройствами эндогенные ритмы.
Это, например, касается особой проблемы измерений ритма температуры тела, которая легко и быстро меняется в зависимости от моторной активности, изменений позы, пищи и пр. Концентрации кортизола повышаются в условиях стресса, особенно в вечернее время; соответственно, показатели этого циркадианного маркера также часто маскируются психофизиологическими реакциями.
Секреция мелатонина (гормон эпифиза), который считается наиболее информативным показателем для оценки фазы циркадианного ритма, подавляется действием света, особенно в вечернее время, чувствительность к такому воздействию настолько высока, что для снижения его активности достаточно светового потока 100 люкс [10].
Соответственно, даже искусственный свет в помещении может привести к значительной задержке начала ночной экскреции мелатонина. Только в последнее десятилетие были разработаны протоколы контролируемых исследований, предусматривающие применение современных хронобиологических методов оценки с точными маркерами циркадианного ритма.
Четвертый вопрос касается ценности разных моделей. Концепция генетических и связанных со стрессом факторов предрасположенности к депрессии может рассматриваться как в аспекте нейротрансмиттерных систем, так и нарушений регуляции циркадианного ритма. В этой публикации остановимся на двухпроцессной модели регуляции сна-пробуждения [11] как методе изучения некоторых аспектов депрессивной симптоматики.
И наконец, последний вопрос: позволят ли знания об эффектах клинически успешных методов хронобиологической терапии вскрыть предполагаемые в основе аффективного расстройства циркадианные механизмы? Манипуляции с циркадианным ритмом или сном действительно способствуют редукции депрессии и дают несколько перспективных подсказок для решения этого вопроса.
Клинические наблюдения
Клинические наблюдения свидетельствуют о периодичности аффективных расстройств (от сезонных обострений до 48-часовых быстрых циклов); суточные колебания в тяжести симптоматики, ранние утренние пробуждения и расстройства сна относятся к классическим симптомам депрессии, связывающим ее с функцией циркадианного ритма. Многие ритмы, такие как вариации температуры тела, концентраций кортизола, метаболизма моноаминов, изменяются у больных с депрессией: фазное смещение (более раннее) цикла сон-бодрствование, снижение амплитуды и/или повседневные вариации в их синхронизации в зависимости от социальных факторов [1].
Однако нарушения ритмичности могут быть как причиной, так и следствием аффективного расстройства. И в том и в другом случае они могут независимо отражать патологические изменения в третьей системе, такой как психомоторная активность. Отчетливая лабильность может быть вызвана исключительно утратой адекватной обратной связи с циркадианной системой (например, редукция активности).
Более того, расстройства сна обнаруживают крайне сложные связи с депрессивным заболеванием. Эти клинические наблюдения поддаются формализации в аспекте физиологии циркадианных ритмов и сна.
Нейробиология циркадианных ритмов
Циркадианные ритмы генерируются главным водителем этих ритмов, расположенным в супрахиазматических ядрах (СХЯ) в переднем гипоталамусе [12].
Индивидуальная генетически обусловленная предрасположенность к эндогенной периодичности несколько отличается от 24 ч (обычно дольше) и требует ежедневной 24-часовой синхронизации с помощью экзогенных факторов, управляющих биологическими часами живого организма — синхронизаторами (водители ритмов), которые представляют собой регулярно повторяющиеся стимулы окружающей среды. Свет является главным синхронизатором для СХЯ, который передается с помощью особых фоторецепторов ганглиозных клеток сетчатки [13].
Этот невизуальный и не формирующий зрительных образов нервный путь, проходящий через ретиногипоталамический тракт, подсчитывает количество фотонов, особенно в закатное и рассветное время, и активно управляется вторыми часами в глазах [14].
Непрямой зрительный путь достигает СХЯ через межколеновидный листок латерального коленовидного комплекса. Исходящий из ядра шва серотонинергический путь передает несветовые импульсы в СХЯ и, вероятно, играет важную роль при депрессии, так как в этих ядрах выявляются самые высокие концентрации серотонина (5-HT) в головном мозге. Важный исходящий путь ведет из СХЯ к паравентрикулярному ядру (ПВЯ) и далее, через мультисинаптические пути, к эпифизу, в котором происходит синтез мелатонина. Эпифиз синтезирует мелатонин в ночное время и не продуцирует его в течение всего дня. Мелатонин передает ночной сигнал телу путем ночной продукции этого гормона («в пределах дня») [15].
Показано, что появление мелатонина в крови ранним вечером является наиболее надежным биологическим маркером циркадианного ритма (образцы, полученные в условиях тусклого света) [16].
ПВЯ также является участком синтеза кортикотропин-рилизинг-фактора (кортиколиберина), т. е. является отделом гипоталамо-гипофизарно-надпочечниковой (ГГН) системы. Снижение ритма кортизола обеспечивает надежный сигнал от часов СХЯ (тогда как максимальный уровень определяется средовыми факторами) [17].
Стимулы синхронизаторов, из которых наиболее важным является свет, могут смещать фазу и, следовательно, регулировать активность СХЯ [18, 19]. Свет в первой половине ночи вызывает отсрочку фазы, тогда как свет во второй половине ночи (после того как температура тела достигает минимального уровня) провоцирует более раннее начало фазы [18, 19]. Назначение экзогенного мелатонина вызывает почти противоположный эффект смещения фаз под влиянием света [20].
Другие несветовые синхронизаторы (физические нагрузки; возможно, сон или темнота; пищевые продукты) изучены в меньшей степени и, вероятно, являются более слабыми стимулами в сравнении со светом [21].
Социальные синхронизаторы (работа, социальные требования или нормы, межличностные отношения) могут оказывать как прямое, так и опосредованное влияние на СХЯ, так как они определяют время приема пищи, сна, физических нагрузок и воздействия дневного света. Эти социальные факторы также могут вызывать нарушения циркадианных ритмов [22].
Некоторые из психосоциальных факторов развития депрессии, такие как события в жизни, хронический стресс или недостаточно эффективные системы социальной помощи, также могут действовать как факторы, вызывающие нарушения циркадианных ритмов.
Часы повсюду
Концепция главного водителя ритма, генерирующего все циркадианные ритмы, оказалась очень продуктивной. Тем не менее ее необходимо дополнить концепцией периферических часов, имеющихся в каждом органе и, возможно, в каждой клетке организма [23].
Каждый орган имеет свой собственный и специфично отрегулированный циркадианный ритм (частота сердечных сокращений, метаболизм в печени, почечный транспорт) и генную экспрессию. В нормальном состоянии роль синхронизатора всех ритмов выполняет СХЯ [23].
Сигнал из СХЯ трансформируется, преимущественно в ПВЯ, в гормональный или вегетативный сигнал для периферических органов. Висцеральная, сенсорная и гормональная информация передается по системе обратной связи в гипоталамус, способствуя тонкой настройке для синхронизации времени суток внешнего цикла день-ночь с метаболической информацией, поступающей изнутри организма. Фаза каждого ритма может корректироваться различными реакциями циркадианных часов данной ткани в ответ на сигналы от СХЯ или окружающей среды. Такая система способна эффективно адаптироваться к малейшим и постепенным изменениям входящего сигнала (например, сезонные изменения светового дня), но также предрасположена к транзиторным и тяжелым нарушениям, если изменения фазы такого сигнала прерываются или чрезмерно увеличиваются (что наиболее отчетливо наблюдается при путешествии с быстрой сменой часовых поясов или изменении режима работы).
Как может нарушаться эта система при аффективных расстройствах? Рассмотрим вегетативные симптомы, которые считаются составной частью депрессивного синдрома и часто выступают как предшественники депрессии. Если сон утрачивает точное соответствие внутренним или внешним часам, если увеличивается количество потребляемой пищи или происходит инверсия поведения, в связи с которой снижается моторная активность и сокращается длительность действия естественного света (а также ограничиваются социальные контакты), не удивительно, что подобные изменения в поведении оказывают влияние на разные часы, в той или иной степени смещая их время относительно друг друга и относительно цикла день-ночь. Такой временной беспорядок может вызвать внутреннюю стрессовую реакцию. С позиции концепции о едином результирующем нейроэндокринном факторе депрессии — гиперактивности системы ГГН — можно говорить о важности этой регулирующей системы в отношении как физиологических, так и психических функций.
Гены часов, гены сна
Индивидуальные предпочтения во времени цикла сон-бодрствование (хронотип, т.е. «жаворонки» или «совы») [24] определяются генами часов, 10 из которых уже клонированы на сегодняшний день [25].
Индивидуальная продолжительность сна и бодрствования (долго спящие против мало спящих) также, по всей видимости, запрограммирована в определенных генах сна [26].
Поскольку время сна имеет достаточно большое значение для настроения, эти генетические факторы могут играть важную роль в хронобиологической уязвимости при депрессии — несоответствие или недостаточное соответствие внутренней фазы по отношению к фазе внешней среды повышает предрасположенность к депрессивному изменению настроения. Несмотря на выявление семейных форм циркадианных расстройств сна (синдром ранней или поздней фазы сна) с аллельными мутациями в одном или нескольких генах [27, 29], первые исследования этих факторов при депрессии не дали положительных результатов (например, оценка гена часов при большой депрессии [30] или per se гена при биполярном расстройстве [31]).
Полиморфизм, связанный с циркадианными часами, по-видимому, связан с одновременной предрасположенностью к САР и вечернему хронотипу [32].
Однако эти исследования пока находятся лишь на начальной стадии.
Десинхронизация циркадианного ритма
Однако представляется маловероятным, что аффективные расстройства являют собой всего лишь результат мутации генов часов. Скорее всего, внутренняя десинхронизация может быть одним из важных факторов, участвующих в развитии аффективной патологии. Новые данные по десинхронизации в экспрессии гена часов подтверждают это предположение. Гены часов в СХЯ постепенно адаптируются к смещению фазы цикла свет-темнота (как установлено при изменении режима работы и путешествиях со сменой часовых поясов), тогда как гены часов в мышцах, печени и легких ресинхронизируются на своих собственных частотах [33].
Это приводит к двойной десинхронизации, не только между внутренним (СХЯ) и внешним временем, но также между разными часами и органами внутри тела. Более того, часы разных органов реагируют на разные, специфичные для них синхронизаторы, например: прием пищи может довольно быстро стимулировать перестановку часов в печени, тогда как свет не оказывает влияния на ритм печени; часы СХЯ реагируют на свет, но индифферентны по отношению к пище [34].
Периферические часы в мышцах могут ресинхронизироваться под влиянием физических нагрузок. Эти данные способствуют новому подходу к пониманию расстройств циркадианного ритма при депрессии. Поскольку функции периферических часов дополняют функцию центральных часов в поддержании биологического ритма, множество часов в организме и головном мозге только повышает вероятность нарушений в системе регуляции циркадианных ритмов. Причем разные варианты десинхронизации могут приводить к одинаковым физиологическим или психологическим последствиям. Классическая теория расстройств внутреннего циркадианного ритма при депрессии может быть расширена за счет смещений фазы, связанных с синхронизаторами [6].
Даже небольшое снижение интенсивности водителей ритмов или ограничение поведения может ослаблять функцию координации времени не только между внутренними ритмами, но и в соответствии с социальными и физическими часами, что в конечном итоге может приводить к нарушениям настроения, изменениям в суточных колебаниях настроения и ежедневной лабильности настроения. Однако нейробиологические механизмы, под действием которых нарушения циркадианных фазных соотношений реализуются в аффективных расстройствах, остаются неизвестными. Биполярное расстройство, особенно протекающее с быстрой сменой циклов, является наиболее ярким примером аффективной патологии, связанной с аномалиями или изменениями в фазе циркадианного ритма [1].
В этих случаях окружающая среда (свет или темнота), а также поведение (сон или его недостаток) [35] в значительной степени влияют на аффективное состояние. Причем в последнее время эти факторы начали использовать в терапии аффективных расстройств [36-39].
Регуляция сна
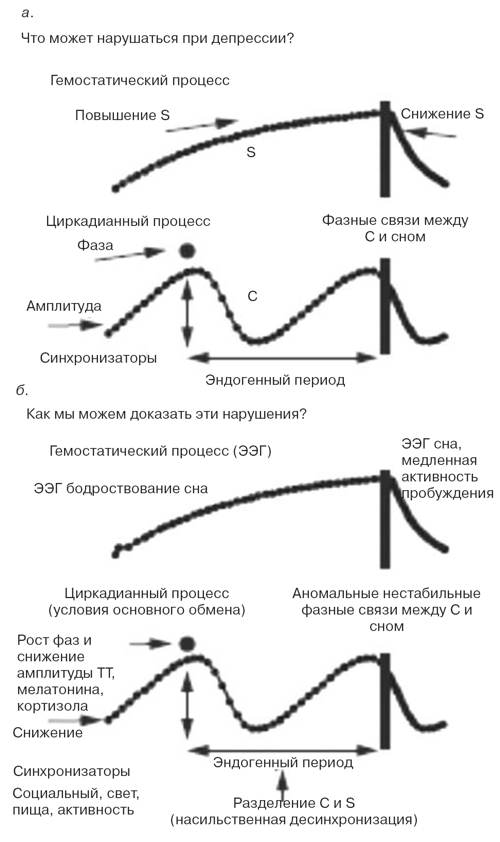
Цикл сон-бодрствование является наиболее отчетливым циркадианным ритмом у человека, а нарушения сна относятся к выраженным клиническим проявлениям депрессии. На двухпроцессной модели регуляции сна показано, что гомеостатический процесс S усиливается во время бодрствования и ослабляется во время сна; он взаимодействует с циркадианным процессом C для определения распорядка и архитектуры сна [11].
Эта модель также может использоваться для описания возможных нарушений каждого из этих процессов при депрессии (см. рисунок).
Клинические расстройства сна с ранними пробуждениями могут быть связаны с нарушениями в активности процесса S при пробуждении (снижение связанного со сном давления) или со смещением процесса С на более раннее время. Известно множество методов манипуляций со сном, способствующих улучшению клинического статуса (см. далее и таблицу).
Предполагается, что быстрый антидепрессивный эффект депривации сна в течение одной ночи объясняется кратковременным повышением активности процесса S до нормального уровня [40].
Замедление антидепрессивного эффекта фазного смещения в цикле сон-бодрствование [8] может быть связано с более медленной нормализацией фазных соответствий по отношению к процессу C. Другой вероятной причиной может быть ослабление процесса S во время сна либо снижение циркадианного периода, фазы или амплитуды (процесс C).
Как измерить процессы С и S
Приведенная модель позволяет уточнить, какие именно биологические маркеры можно измерять для тестирования данной гипотезы (см. рисунок, б).
Очень важно использовать корректную методологию для определения экспериментальных условий, способствующих минимизации маскирующих феноменов. Существует два основных подхода, каждый из которых требует соблюдения строгих протоколов с высоким уровнем контроля. Первый протокол — «условия основного обмена», при котором субъекты остаются в состоянии бодрствования в течение 24 ч или дольше при неизменных внешних и поведенческих условиях (очень низкий уровень освещения, исключающий влияние света на водитель циркадианного ритма; положение лежа на спине в кровати и регулярный прием малых количеств изокалорийной пищи).
Условия основного обмена способствуют сбору информации о процессе C, например оценки амплитуды и фазы ритмов секреции мелатонина и кортизола, а также колебаний температуры тела [18].
Только такие параметры, не подвластные влиянию депривации сна, могут быть надежными циркадианными маркерами. Второй протокол — «насильственная десинхронизация», при которой субъекты живут в условиях очень длительного или очень короткого цикла сон-бодрствование, при этом часы сохраняют свой эндогенный цикл, несколько превышающий 24 ч. Этот протокол позволяет проводить количественную оценку многих показателей по отношению ко времени суток (процесс C) или длительности предыдущего периода бодрствования (процесс S) [18].
Процессы C и S при САР
Оба протокола — условия основного обмена и форсированная десинхронизация — использовались в исследованиях пациентов с САР как с депрессией, так и с эутимией, в летний и зимний сезоны. Эндогенные периоды были нормальными [41].
Выявлена задержка фазы в процессе C (по показателям температуры тела или ритмов секреции мелатонина в условиях основного обмена) [42], однако не во всех исследованиях и не по всем маркерам [41, 43]. Снижение активности процесса S (по показателям спектрального анализа ЭЭГ сна) было одинаковым у пациентов с САР и группы контроля [44, 45]. Однако повышение активности процесса S (по данным спектрального анализа ЭЭГ в состоянии бодрствования) было различным, что указывает на фактор, связанный с состоянием бодрствования в дневное время [46, 47]. Причем установленные параметры ЭЭГ были такими же, как у лиц с вечерним хронотипом [48], в связи с чем можно предположить, что приведенные данные не имеют отношения к патогенезу САР, так как смещение хронотипов пациентов в сторону «сов» обнаруживает указанную выше тенденцию к отсрочке фазы и характеризуется типичным связанным с часами полиморфизмом [32].
Война синхронизаторов
Интересно, что и циркадианные, и зависящие от бодрствования факторы вносят вклад в субъективную оценку собственного состояния, включая настроение, что было показано на здоровых субъектах при использовании обоих протоколов [6, 41, 49, 50]. Ежедневные изменения в параметрах суточных колебаний настроения при насильственной десинхронизации обнаруживают значительное сходство с суточными колебаниями аффекта у больных с депрессией и даже еще в большей степени сопоставимы с колебаниями настроения после фазного смещения в цикле сон-бодрствование [8].
Таким образом, колебания настроения могут рассматриваться в аспекте аномалий или изменений в фазных взаимосвязях. Считается, что связанные с аффективной патологией когнитивные расстройства возникают в результате последовательности фазных смещений в циркадианных ритмах [3].
Это очень важный результат представленного выше исследования. Если пациенты с САР чувствительны к зимнему сокращению светового дня, то чем это объясняется — аномалиями в биологических часах или субъективной интерпретацией внутреннего нарушения ритма времени? Представленные данные подтверждают такое предположение. У некоторых субъектов, участвовавших в этом эксперименте, после устранения стимулов времени отмечена спонтанная внутренняя десинхронизация с нарушением синхронности между циклом сон-бодрствование и циркадианными ритмами, такими как температура тела. Субъекты не осознавали этих изменений и не обнаруживали снижения настроения или активности, напротив, они отмечали улучшение самочувствия [51].
Эти данные в значительной степени контрастируют с ситуацией экзогенной десинхронизации, когда распорядок сна смещается вслед за изменением режима работы или пересечением часовых поясов. В этих случаях внутренняя десинхронизация между сном и часами усиливается в результате конфликта со световой фазой и социальными синхронизаторами окружающей среды; постулируется, что эти процессы могут лежать в основе депрессивных расстройств [5, 52]. Это может быть связано не только с фазными соотношениями, которые, несомненно, важны, но, вероятно, и с пропорцией свет-темнота (продолжительность дня или фотопериод).
Некоторые данные, полученные при САР, позволяют предположить, что длительность ночной секреции мелатонина имеет большое значение для развития психопатологических расстройств в зимнее время [53].
С другой стороны, в исследовании здоровых добровольцев, находившихся в условиях длинной зимней ночи, у одного субъекта развились тяжелые суицидальные явления, хотя самочувствие всех других участников оставалось очень хорошим [54].
Соответственно, суточные колебания или нестабильность настроения можно объяснить изменениями в фазных соотношениях между процессами C и S. Даже у здоровых субъектов некоторые фазные отношения благоприятны, другие — неблагоприятны. Умеренное, но значимое снижение настроения наблюдается после задержки фазы в цикле сон-бодрствование [5, 55]. Внезапные отсрочки (вызванные смещением работы на ночь или перелетом на запад с пересечением нескольких часовых поясов) способны даже провоцировать депрессию у предрасположенных лиц с аффективными расстройствами в анамнезе [56, 57]. Эти данные свидетельствуют об особом повышении риска аффективных расстройств при дальнейшем смещении фазы по отношению к циркадианным ритмам. Эти связи также подтверждаются и в случаях циркадианных расстройств сна в форме синдрома отставленной фазы сна (неадекватно позднее засыпание по отношению к эндогенным циркадианным часам).
У таких лиц выявляется высокий уровень коморбидных депрессивных симптомов [58].
В свою очередь перелет на восток коррелирует с развитием гипоманиакальных и маниакальных состояний [56, 57].
Психофармакология и циркадианные ритмы
Первые данные о связи психофармакотерапии с циркадианными ритмами отмечены при наблюдениях замедления циркадианной периодичности у растений под влиянием лития [59].
Такие эффекты лития проявляются в разных видах, включая человека [60], и выявляются даже на уровне отдельных нейронов в СХЯ [61].
Однако попытки экстраполяции этих данных на разные классы антидепрессантов не увенчались успехом [7].
Даже несмотря на то что ингибитор моноаминоксидазы (ИМАО) клоргилин увеличивает циркадианный период [62], другой ИМАО, моклобемид, сокращает этот период [63], а селективные ингибиторы обратного захвата серотонина (СИОЗС) вовсе не оказывают таких влияний [63].
При обращении к представленной выше модели (см. рисунок, а) становится очевидным, что препараты не только могут действовать на циркадианный период, но и способны вызывать смещение фазы или влиять на соотношения между фазами и циклом сон-бодрствование, повышая циркадианную амплитуду или чувствительность к синхронизаторам. Особый интерес представляют данные о том, что имипрамин и литий изменяют фазное соотношение между циркадианным ритмом температуры тела и циклом отдых-активность [64], а также концепция, рассматривающая стабилизацию циркадианных ритмов в качестве ключевого механизма действия клинически эффективных стабилизаторов настроения [65].
Более того, допускается влияние на чувствительность к свету, как это было показано при длительной терапии клоргилином или литием [66].
| Двухпроцессная модель регуляции сна для выявления нарушений при депрессии: а — гомеостатический компонент (процесс S) нарастает во время бодрствования и снижается во время сна. Водитель циркадианного ритма (процесс C) работает в своем индивидуальном (генетически запрограммированном) эндогенном режиме. Снижение амплитуды приводит к нарастанию вариабельности суточного времени и определяется повышенной предрасположенностью к фазному смещению. Если ритм сокращается или удлиняется по фазе, нарушения в фазных соотношениях между процессом C и распорядком сна могут служить объяснением для многих депрессивных феноменов;
б — биологические маркеры процесса S и процесса C. Экспоненциальное повышение давления сна может сопровождаться увеличением тета-альфа (q/a)-активности на электроэнцефалограмме (ЭЭГ) в состоянии бодрствования. Экспоненциальное снижение давления сна реализуется повышением медленноволновой активности на ЭЭГ сна. В условиях основного обмена ритмы колебаний температуры тела (ТТ), мелатонина и кортизола обеспечивают оценку циркадианной фазы и амплитуды. В условиях насильственной десинхронизации возможна редукция эндогенной фазы водителя циркадианного ритма, а также относительное влияние процесса C и процесса S на все измеряемые показатели, как психологические, так и физиологические. |
Методы хронобиологической терапии большой депрессии. Курсив — методы терапии, изучавшиеся только в одном или двух исследованиях
Нефармакологическая терапия
Депривация сна
Достоверно установлено, что тотальная депривация сна приводит к быстрой редукции депрессивной симптоматики, которая, однако, быстро возобновляется после восстановления нормального сна, что свидетельствует о тесной взаимосвязи депрессивного расстройства и нарушений сна [8].
Дополнительно для оптимального антидепрессивного эффекта депривации сна требуется совпадение с ранней утренней циркадианной фазой. Не менее эффективны такие методы, как парциальная депривация сна во второй половине ночи или смещение вперед фазы цикла сон-бодрствование (см. таблицу).
Спонтанная инверсия аффекта при депрессии (с развитием мании или гипомании) часто наблюдается после «естественной» депривации сна. Такой выраженный и незамедлительный антидепрессивный эффект депривации сна был замечен более 30 лет назад, однако этот метод не находит широкого применения в современной клинической практике. На первый взгляд эта ситуация выглядит парадоксальной — лишение сна пациента, уже страдающего связанной с депрессией инсомнией (возможно, термин «терапия бодрствованием» был бы более позитивным обозначением).
Наверное, ограниченное использование этого метода объясняется в первую очередь кратковременностью терапевтического эффекта, хотя степень клинических изменений при депривации сна по-прежнему представляется крайне интригующей и, может быть, будет способствовать пониманию патофизиологии депрессии. Депривация сна представляет собой типичную модель для исследований депрессии, благодаря быстрому нефармакологическому и кратковременному эффекту. Вероятно, нефармакологическая природа депривации сна (ее нельзя запатентовать) стала причиной для обозначения этого метода как «осиротевшего лекарства» [67].
Удивительно, что ни одна из фармакологических компаний еще не использовала эту модель в своем научном поиске столь необходимого быстродействующего антидепрессанта [8].
Возможно, в будущем ситуация изменится к лучшему; данные последенится к лучшему; данные последних исследований свидетельствуют о том, что хотя функция сна связана с небольшим числом генов, состояние бодрствования связано с повышением экспрессии нескольких групп генов [68].
В связи с этим в условиях сравнения по эффективности с антидепрессантами круг кандидатных генов может сузиться. Некоторые убежденные сторонники депривации сна указывают на ценность этого метода для ускорения антидепрессивного эффекта терапии в первую очередь у пациентов с тяжелой депрессией, для которых скорость улучшения имеет особое значение. Депривация сна эффективна при всех диагностических типах депрессии. Серьезной проблемой, связанной с депривацией сна, является быстрое возобновление депрессивной симптоматики после восстановления нормального сна, в связи с чем разрабатываются новые стратегии терапии, позволяющие решить эту проблему. Показано, что повышению стойкости эффекта депривации сна способствует терапия литием, антидепрессантами (особенно СИОЗС) или агонистом рецепторов 5-HT 1A пиндололом, а также дополнительными нефармакологическими методами, включая повторную транскраниальную магнитную стимуляцию (rTMS) [69], светотерапию, фазное смещение цикла сон-бодрствование или различные комбинации перечисленных методов (см. таблицу) [8, 36, 70].
Светотерапия
Светотерапию можно считать наиболее успешным практическим применением концепции циркадианных ритмов в психиатрии. Светотерапия является методом выбора в лечении пациентов с САР [71].
Современные исследования САР проводятся на высоком уровне и подтверждают достоверное превосходство этого метода над плацебо по долям респондеров (фактически даже более выраженное отличие от плацебо в сравнении с результатами исследований антидепрессантов) [72].
Успех этого нефармакологического метода терапии поразителен, однако потребуется еще достаточно длительное время, прежде чем светотерапия будет признана официальной психиатрией [72], а ее исследования по другим показаниям пока находятся на экспериментальном уровне. Высокий эффект при САР ограничивает применение светотерапии при других формах депрессии — ее резервируют как «хронобиологическое лечение для хронобиологической подгруппы больных депрессией». Однако свет действует на те же нейротрансмиттеры (в первую очередь на серотонин), на которые действуют основные антидепрессанты [71].
Это подтверждено результатами тестов с расщеплением триптофана, в соответствии с которыми у пациентов с САР показатели спровоцированных дефицитом триптофана рецидивов депрессии после успешной светотерапии были такими же, как после эффективной терапии СИОЗС [71].
Более убедительные доказательства незамедлительного эффекта света на обмен серотонина в головном мозге были получены в исследовании in vivo с участием здоровых добровольцев: наряду с сезонными колебаниями обмена серотонина с его повышением в весенние и летние периоды и снижением в осенние и зимние периоды (показатель, связанный с количеством часов светового дня) показано, что обмен серотонина немедленно усиливается при воздействии света [73].
Если допустить, что аффективное состояние как минимум частично связано с обменом серотонина, то вывод очевиден: чем больше света, тем лучше настроение. Связь с серотонином предполагает более широкие показания для светотерапии. Быстрый эффект, развивающийся на первой неделе у пациентов с САР, вовсе не означает, что пациенты с другими типами большой депрессии будут реагировать столь же быстро: требуются более длительные курсы светотерапии, от 4 до 6 нед, как и при использовании антидепрессантов. Уже получены убедительные доказательства эффективности светотерапии при булимии, а также предварительные данные о пользе этого метода в случаях предродовых и послеродовых депрессий (состояния, при которых необходимость нелекарственных методов лечения крайне высока) [74] и многообещающие предварительные результаты в лечении большой депрессии, в первую очередь в качестве дополнения к антидепрессантам (см. таблицу) [14].
Установлено, что свет не только является важным синхронизатором, необходимым для повседневного хорошего самочувствия, но также и «лекарством», которое позволяет выбирать специфичные дозы, время и длительность в зависимости от диагноза [71].
Важной информацией для клиницистов является тот факт, что в настоящее время проводится анализ данных всех доступных рандомизированных исследований светотерапии при САР и несезонных депрессиях, результаты которого вскоре будут опубликованы в Библиотеке Кохрана.
Терапия темнотой
Результаты исследований, выполненных на единичных клинических наблюдениях при биполярном расстройстве с быстрой сменой циклов, свидетельствуют, что увеличение продолжительности темного времени суток (либо отдыха или сна) немедленно останавливает рекуррентное течение, что представляется удивительно высоким терапевтическим эффектом в этой подгруппе пациентов, как правило, резистентных к лечению [38, 39]. Дополнительным подтверждением этих результатов служат недавно полученные данные о том, что увеличение продолжительности темного времени суток (но не отдых и не сон) способствует редукции симптомов мании в течение нескольких дней (B. Barbini, личное сообщение).
Гормон эпифиза мелатонин называют «гормоном темноты». Мелатонин играет важную физиологическую роль, так как определяет распорядок запуска каскада явлений, инициирующих сон у человека [20].
Начинающаяся ночью секреция мелатонина сопровождается возникновением потребности в сне, включая периферические терморегулирующие механизмы [75].
«Эффект теплых ступней» лежит в основе усыпляющего действия мелатонина и используется при многих расстройствах сна [20].
В единичных исследованиях у больных с депрессией показано, что назначение мелатонина способствует улучшению сна, но не оказывает влияния на настроение [76, 77].
Грядущие методы терапии
Новый антидепрессант агомелатин — агонист мелатонина и антагонист 5-HT 2С -рецепторов, обладающий прямым действием на циркадианные ритмы, — в настоящее время находится на стадии клинической разработки в качестве средства терапии аффективных расстройств. В большом многоцентровом исследовании агомелатина при большой депрессии получены данные о высоком антидепрессивном эффекте [78], связанном с действием препарата на мелатонинергические и серотонинергические системы. Более того, влияние на рецепторы подтипа 5-HT2С считается важным компонентом антидепрессивного эффекта СИОЗС, а в аспекте связи с хронобиологией антагонизм в отношении 5-HT2С -рецепторов имитирует эффекты света на ЦНС крыс [79].
Смещение фазы сна и синхронизаторы в качестве методов терапии
Изложенная выше концепция предполагает мультимодальный подход к применению хронобиологических методов терапии при большой депрессии. «Терапия бодрствованием» (с повышением активности процесса S) обеспечивает быстрое клиническое улучшение при всех диагностических подтипах депрессии, а повышению стойкости достигнутого эффекта способствует фазное смещение (изменение распорядка сна), свет, серотонинергические препараты или rTMS (которая воздействует на СХЯ [80]).
Увеличение силы синхронизаторов улучшает устойчивость реакции и циркадианную амплитуду: это может быть одним из механизмов терапевтического эффекта яркого света или агониста мелатонина. Получены доказательства того, что больные депрессией, включая пациентов с САР, характеризуются более выраженной повседневной и суточной вариабельностью настроения в сравнении с контрольными субъектами [81, 82]. При этом у пациентов с САР показано, что увеличение силы синхронизаторов при светотерапии способствует редукции или полному исчезновению подобных различий в вариабельности настроения [82].
Другие синхронизаторы (социальные факторы, активность и прием пищи) имеют большое значение для улучшения поведенческой обратной связи — от периферических часов к общей стабильности реакции на стимулы, что крайне важно в случаях биполярного расстройства [37].
Искомая комбинация для достижения быстрого и стойкого антидепрессивного эффекта может включать эклектическую смесь из этих нефармакологических методов и антидепрессантов.
Заключение
Мы живем в обществе с 24-часовой ориентацией, которое уже не имеет строгой синхронизации с сезонными изменениями в продолжительности светового дня и температуре. Всесезонный «летний день» является результатом искусственного освещения, хотя и недостаточной интенсивности для стабильной стимуляции. Слишком мало известно о последствиях нерегулярности действия света для чувствительной циркадианной системы, как и о том, каким образом свет может провоцировать или редуцировать депрессивную фазу. Может быть, повышение распространенности депрессии в современном обществе отчасти связано и с этими изменениями? Каждый из таких факторов, как генетическое предрасположение, гормональные флюктуации, средовый стресс и нарушения в цикле свет-темнота, может вызывать нарушения ритма. В свою очередь расстройства сна, чрезмерное напряжение, расстройства пищевого поведения и аффективная патология могут влиять на циркадианную систему через обратную связь посредством гормонов и влияния на периферические осцилляторы. Эти новые знания способствуют разработке эффективных стратегий и методов повышения устойчивости водителя циркадианного ритма, а также улучшению синхронизации его активности с циклом день-ночь. Представляется интересным переоценить эмпирически созданные в XIX веке методы психиатрического лечения, предусматривающие регулярность социальной активности и приема пищи, а также манипуляции со сном и температурой (холодные ванны) с позиций современной хронобиологии и важности корректного режима действия синхронизаторов.
Литература
[Электронный ресурс]//URL: https://psychoexpert.ru/kursovaya/affektivnyie-rasstroystva-2/
1. Wehr TA, Goodwin FK. Biological rhythms in manic-depressive illness. In: Wehr TA, Goodwin FK, eds. Circadian Rhythms in Psychiatry. Pacific Grove, Calif: The Boxwood Press 1983; 129-84.
2. Wu JC, Bunney WE. The biological basis of an antidepressant response to sleep deprivation and relapse: review and hypothesis. Am J Psychiat 1990; 147: 14-21.
3. Kuhs H, Tolle R. Sleep deprivation therapy. Biol Psychiat 1991; 29: 1129-48.
4. Leibenluft E, Wehr TA. Is sleep deprivation useful in the treatment of depression? Am J Psychiat 1992; 149: 159-68.
5. Healy D, Waterhouse JM. The circadian system and the therapeutics of the affective disorders. Pharmacol Ther 1995; 65: 241-63.
6. Wirz-Justice A. Biological rhythms in mood disorders. In: Bloom FE, Kupfer DJ, eds. Psychopharrnacology: The Fourth Generation of Progress. New York, NY: Raven Press, 1995; 999-1017.
7. Rosenwasser AM, Wirz-Justice A. Circadian rhythms and depression: clinical and experimental models. In: Redfern PH, Lemmer B, eds. Physiology and Pharmacology of Biological Rhythms. Berlin, Germany: Springer Verlag, 1997; 457-86.
8. Wirz-Justice A, Van den Hoofdakker RH. Sleep deprivation in depression: what do we know, where do we go? Biol Psychiat 1999; 46: 445-53.
9. Boivin DB. Influence of sleep-wake and circadian rhythm disturbances in psychiatric disorders. J Psychiatry Neurosci 2000; 25: 446-58.
10. Zeitzer JM, Dijk DJ, Kronauer RE et al. Sensitivity of the human circadian pacemaker to nocturnal light: melatonin phase reset-ting and suppression. J Physiol 2000; 526: 695-702.
11. Daan S, Beersma DGM, Borbely AA. Timing of human sleep: recovery process gated bya circadian pacemaker. Am J Physiol 1984; 246: R161-83.
12. Klein DC, Moore RY, Reppert SM. Suprachiasmatic Nucleus: The Mind’s Clock. New York, NY: Oxford University Press, 1991.
13. Berson DM, Dunn FA, Takao M. Phototransduction by retinal ganglion cells that set the circadian clock. Science 2002; 295: 1070-3.
14. Reme CE, Wirz-Justice A, Terman M. The visual input stage of the mam-malian circadian pacemaking system: i. Is there a clock in the mammalian eye? J Biol Rhythms 1991; 6: 5-29.
15. WehrTA. Photoperiodism in humans and other primates: evidence and implications. J Biol Rhythms 2001; 16: 348-64.
16. Lewy AJ. The dim light melatonin onset, melatonin assays and biolog-ical rhythm research in humans. Biol Signals Recept 1999; 8: 79-83.
17. Linkowski P, Van Onderbergen A, Kerkhofs M et al. Twin study of the 24-h Cortisol profile: evidence for genetic control of the human circadian clock. Am J Physiol 1993; 264: E173-81.
18. CzeisIer CA, Khalsa SBS. The human circadian timing system and sleep-wake regulation. In: Kryger MH, Roth T, Dement WC, eds. Principles and Practice of Sleep Medicine. 3rd ed. Philadelphia, Pa: WB Saunders Company, 2000; 353-75.
19. Honma Kl, Hashimoto S, Nakao M, Honma S. Period and phase adjust-ments of human circadian rhythms in the real world. J Biol Rhythms 2003; 18: 261-70.
20. Czeisler CA, Cajochen C, Turek FW. Melatonin in the regulation of sleep and circadian rhythms. In: Kryger MH, Roth T, Dement WC, eds. Principles and Practice of Sleep Medicine. 3rd ed. Philadelphia, Pa: WB Saunders Company 2000; 400-6.
21. Danilenko KV, Cajochen C, Wirz-Justice A. Is sleep per se a zeitgeber in humans? J Biol Rhythms 2003; 18: 170-8.
22. Monk TH, Kupfer DJ, Frank E, Ritenour AM. The Social Rhythm Metric (SRM): measuring daily social rhythms over 12 weeks. Psychiatry Res 1991; 36: 195-207.
23. Buijs RM, Kalsbeek A. Hypothalamic integration of central and periph-eral clocks. Nature Rev Neurosci 2001; 2: 521-6.
24. Roenneberg T, Wirz-Justice A, Merrow M. Life between clocks: daily temporal patterns of human chronotypes. J Biol Rhythms 2003; 18: 80-90.
25. Roenneberg T, Merrow M. The network of time: understanding the molecular circadian system. Curr Biol 2003; 13: R198-207.
26. Franken P, Chotlet D, Tafti M. The homeostatic regulation of sleep need is under genetic control. J Neurosci 2001; 21: 2610-21.
27. Jones CR, Campbell SS, Zone SE, et al. Familial advanced sleep-phase syndrome: a short-period circadian rhythm variant in humans. Nat Med 1999; 5: 1062-5.
28. Ebisawa T, Uchiyama M, Kajimura N, et al. Association of structural polymorphisms in the human period 3 gene with delayed sleep phase syndrome. EMBO Rep 2001; 2: 342-6.
29. Iwase T, Kajimura N, Uchiyama M et al. Mutation screening of the human Clock gene in circadian rhythm sleep disorders. Psychiatry Res 2002; 109: 121-8.
30. Desan PH, Oren DA, Malison R et al. Genetic polymorphism at the CLOCK gene locus and major depression. Am J Med Genet 2000; 96: 418-21.
31. Shiino Y, Nakajima S, Ozeki Y et al. Mutation screening of the human period 2 gene in bipolar disorder. Neurosci Lett 2003; 338: 82-4.
32. Johansson C, Willeit M, Smedh C et al. Circadian clock-related poly-morphisms in seasonal affective disorder and their relevance to diurnal preference. Neuropsychopharmacology 2003; 28: 734-9.
33. Yamazaki S, Numano R, Abe M et al. Resetting central and peripheral circadian oscillators in transgenic rats. Science 2000; 288: 682-5.
34. Schibier U, Ripperger J, Brown SA. Peripheral circadian oscillators in mammals: time and food. J Biol Rhythms 2003; 18: 250-60.
35. Wehr TA, Sack DA, Rosenthal N. Sleep reduction as a final common pathway in the genesis of mania. Am J Psychiat 1987; 144: 201-4.
36. Benedetti F, Barbini B, Campori E et al. Sleep phase advance and lithium to sustain the antidepressant effect of total sleep deprivation in bipolar depression: new findings supporting the internal coincidence model? J Psychiatr Res 2001; 35: 323-9.
37. Frank E, Swartz HA, Kupfer DJ. Interpersonal and social rhythm therapy: managing the chaos of bipolar disorder. Biol Psychiat 2000;48:593-604.
38. Wehr TA, Turner EH, Shimada JM et al. Treatment of rapidly cycling bipolar patient by using extended bed rest and darkness to stabilize the timing and duration of sleep. Biol Psychiat 1998; 43: 822-8.
39. Wirz-Justice A, Quinto C, Cajochen C et al. A rapid-cycling bipolar patient treated with long nights, bedrest, and light. Biol Psychiatry 1999; 45: 1075-7.
40. Borbeiy AA, Wirz-Justice A. Sleep, sleep deprivation and depression. Hum Neurobiol 1982; 1: 205-10.
41. Koorengevel KM, Beersma DGM, den Boer JA, Van den Hoofdakker RH. A forced desynchrony study of circadian pacemaker characteristics in seasonal affective disorder. J Biol Rhythms 2002; 17: 463-75.
42. Avery DH, Dahl K, Savage MV et al. Circadian temperature and Cortisol rhythms during a constant routine are phase-delayed in hypersomnic winter depression. Biol Psychiat 1997; 41: 1109-23.
43. Wirz-Justice A, Krauchi K, Brunner DP et al. Circadian rhythms and sleep regulation in seasonal affective disorder. Acta Neuropsychiat 1995; 7: 41-3.
44. Brunner DP, Krauchi K, Dijk DJ et al. Sleep electroencephalogram in seasonal affective disorder and in control women: effects of midday light treatment and sleep deprivation. Biol Psychiat 1996; 40: 485-96.
45. Koorengevei K, Beersma D, Den Boer J, van den Hoofdakker R. Sleep in seasonal affective disorder patients in forced desynchrony: an explorative study. J Sleep Res 2002; 11: 347-56.
46. Cajochen C, Brunner DP, Krauchi K et al. EEG and subjective sleepiness during extended wakefulness in seasonal affective disor-der: circadian and homeostatic influences. Biol Psychiatry 2000; 47: 610-7.
47. Putilov A, Donskaya OG, Jafarova OA, Danilenko KV. Waking EEG power density in hypersomnic winter depression. 12th Annual Meeting of the Society for Light Treatment and Biological Rhythms. 7-9 May 2000. Evanston, III. Abstracts p24.
48. Tailiard J, Philip P, Coste O et al. Circadian and homeo-static buildup of sleep pressure during extended wakefulness in morning and evening chronotypes. J Sleep Res 2003. In press.
49. Boivin DB, Czeisler CA, Dijk DJ, et al. Complex interaction of the sleep-wake cycle and circadian phase modulates mood in healthy subjects. Arch Gen Psychiat 1997; 54: 145-52.
50. Schroder C, Knoblauch V, Renz C et al. Circadian modulation of mood under differential sleep pressure conditions. Sleep 2003; 26 (suppl.): A101.
51. Wever RA. The Circadian System of Man: Results of Experiments under Temporal Isolation. New York, NY: Springer Verlag, 1979.
52. Healy D, Minors DS, Waterhouse JM. Shiftwork, helplessness and depres-sion. J Affect Disord 1993; 29: 17-25.
53. Wehr TA, Duncan WCJ, Sher L et al. A circadian signal of change of sea-son in patients with seasonal affective disorder. Arch Gen Psychiatry 2001; 58: 1108-14.
54. Wehr TA, Moul DE, Barbato G et al. Conservation of photoperiod-responsive mechanisms in humans. Am J Physiol 1993; 265: R846-57.
55. Surridge-David M, MacLean A, Coulter ME, Knowles JB. Mood change following an acute delay of sleep. Psychiat Res 1987; 22: 149-58.
56. Jauhar P, Weller MP. Psychiatric morbidity and time zone changes: a study of patients from Heathrow airport. Br J Psychiat 1982; 140: 231-5.
57. Young DM. Psychiatric morbidity in travelers to Honolulu, Hawaii. Compr Psychiat 1995; 36: 224-8.
58. Regestein QR, Monk TH. Delayed sleep phase syndrome: a review of its clinical aspects. Am J Psychiat 1995; 152: 602-8.
59. Engelmann W. Lithium slows down the Kalanchoe clock. Z Naturforsch [B]. 1972; 27: 477.
60. Johnsson A, Engelmann W, Pflug B, Klemke W. Influence of lithium ions on human circadian rhythms. Z Naturforsch [C]. 1980; 35: 503-7.
61. Abe M, Herzdg ED, Block GD. Lithium lengthens the circadian period of individual suprachiasmatic nucleus neurons. Neuroreport 2000; 11: 3261-4.
62. Wirz-Justice A, Campbell IC. Antidepressant drugs can slow or dissociate circadian rhythms. Experientia 1982; 38: 1301-9.
63. Wol!nik F. Effects of chronic administration and withdrawal of antide-pressant agents on circadian activity rhythms in rats. Pharmacol Biochem Behav 1992; 43: 549-61.
64. Nagayama H. Chronic administration of imipramine and lithium changes the phase-angle relationship between the activity and core body tempera-ture circadian rhythms in rats. Chronobiol Int 1996; 13: 251-9.
65. Klemfuss H, Kripke DF. Antimanic drugs stabilize hamster circadian rhythms. Psychiat Res 1995; 57: 215-22.
66. Duncan WC, Johnson KA, Wehr TA. Decreased sensitivity to light of the photic entrainment pathway during chronic clorgyline and lithium treat-ments. J Biol Rhythms 1998; 13: 330-46.
67. Wirz-Justice A. Why is sleep deprivation an orphan drug? Psychiat Res 1998; 81: 281-2.
68. Cirelli C. How sleep deprivation affects gene expression in the brain: a review of recent findings. J Appl Physiol 2002; 92: 394-400.
69. Eichhammer P, Kharraz A, Wiegand R et al. Sleep deprivation in depres-sion stabilizing antidepressant effects by repetitive transcranial magnetic stimulation. Life Sci 2002; 70: 1741-9.
70. Colombo C, Lucca A, Benedetti F et al. Total sleep deprivation combined with lithium and light therapy in the treatment of bipolar depression: replication of main effects and interaction. Psychiat Res 2000; 95: 43-53.
71. Lam RW, Levitt AJ. Canadian Consensus Guidelines for the Treatment of Seasonal Affective Disorder. Canada: Clinical & Academic Publishing, 1999.
72. Wirz-Justice A. Beginning to see the light. Arch Gen Psychiat 1998; 55: 861-2.
73. Lambert GW, Reid C, Kaye DM et al. Effect of sunlight and season on serotonin turnover in the brain. Lancet 2002; 360: 1840-2.
74. Lam RW. Seasonal Affective Disorder and Beyond. Light Treatment for SAD and Non-SAD Conditions. Washington DC: American Psychiatric Press; 1998.
75. Krauchi K, Wirz-Justice A. Circadian clues to sleep onset mechanisms. Neuropsychopharmacology 2001; 25: 592-6.
76. deVries MW, Peeters FP. Melatonin as a therapeutic agent in the treat-ment of sleep disturbance in depression. J Nerv Ment Dis 1997; 185: 201-2.
77. Dolberg OT, Hirschmann S, Grunhaus L. Melatonin for the treatment of sleep disturbances in major depressive disorder. Am J Psychiat 1998; 155: 1119-21.
78. Loo H, Daiery J, Macher JP, Payen A. Pilot study comparing in blind the therapeutic effect of two doses of agomelatine, melatoninergic agonist and selective 5-HT 2C receptors antagonist, in the treatment of major depressive disorders. Encephale 2003; 28: 356-62.
79. Kennaway DJ. Light, neurotransmitters and the suprachiasmatic nucleus control of pineal melatonin production in the rat. Biol Signals Recept 1997; 6: 247-54.
80. Ji R, Schlaepfer T, Aizenman C et al. Repetitive transcranial magnetic stimulation activates specific regions in rat brain. Proc Natl Acad Sci U S A 1998; 95: 15635-40.
81. Hall DP, Sing HC, Romanoski AJ. Identification and characterization of greater mood variance in depression. Am J Psychiat 1991; 148: 418-9.
82. Krauss SS, Depue RA, Arbisi PA, Spoont M. Behavioral engagement level, variability, and diurnal rhythm as a function of bright light in bipolar II seasonal affective disorder: an exploratory study. Psychiat Res 1992; 43: 147-60.
Dialogues in Clinical Neuroscience: 2003; 5 (4): 315-25.
/media/psycho/07_01/52.shtml :: Tuesday, 15-May-2007 12:01:29 MSD
| © Издательство Media Medica, 2000. Почта :: , webmaster |