Белки — полимерные молекулы, в которых мономерами служат аминокислоты. Пептидные цепи содержат десятки, сотни и тысячи аминокислотных остатков, связанных прочными пептидными связями. Благодаря внутримолекулярным взаимодействиям белки образуют особую пространственную структуру, называемую «конформацией белка». Линейная последовательность аминокислот в белке содержит информацию о построении трехмерной пространственной структуры. Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами (рис. 1.1).
Существуют общие правила образования пространственных структур белков.
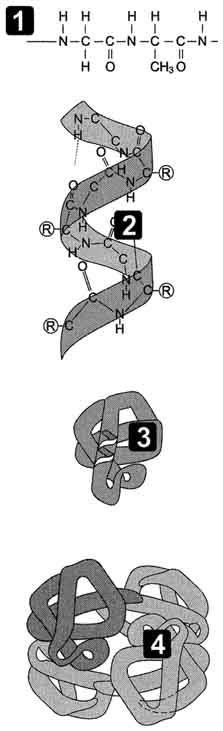
Рис. 1.1 — Этапы формирования конформации белков. 1 — первичная структура; 2 — вторичная структура; 3 — третичная структура; 4 — четвертичная структура.
Аминокислотные остатки в пептидной цепи белка не чередуются случайным образом, а расположены в определенном порядке. Линейная последовательность аминокислотных остатков в полипептидной цепи называется «первичной структурой белка».
Каждый из 50 000 отдельных белков в организме человека имеет первичную структуру, уникальную для этого белка. Все молекулы данного индивидуального белка имеют одинаковое чередование аминокислотных остатков в белке, что главным образом отличает этот единственный белок от любого другого.
Линейные полипептидные цепи отдельных белков за счет взаимодействия функциональных групп аминокислот приобретают определенную пространственную трехмерную структуру, называемую «конформацией». Все молекулы индивидуальных белков (т.е. имеющих одинаковую первичную структуру) образуют в растворе одинаковую конформацию. Следовательно, вся информация, необходимая для образования пространственных структур, находится в первичной структуре белков.
В белках различают 2 основных типа конформации полипептидной цепи: вторичные и третичные структуры.
Вторичная структура белков — это пространственная структура, образованная в результате взаимодействий между функциональными группами, составляющими основу пептида. В этом случае пептидные цепи могут приобретать правильные структуры двух типов: α-спираль и β-структуру.
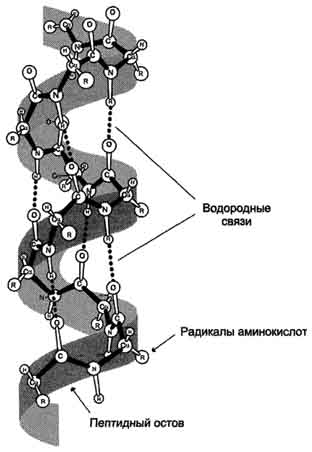 В α-спирали пептидный скелет закручен в форме спирали за счет образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, которые входят в состав пептидных групп через 4 кислоты остаточные аминогруппы. Водородные связи ориентированы вдоль оси спирали (рис. 1.2).
В α-спирали пептидный скелет закручен в форме спирали за счет образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, которые входят в состав пептидных групп через 4 кислоты остаточные аминогруппы. Водородные связи ориентированы вдоль оси спирали (рис. 1.2).
Социометрическая структура группы
... того или иного члена группы. Если обычный вопрос задает некоторое распределение опрашиваемого множества респондентов по изучаемому признаку, то социометрический вопрос задает некоторую структуру отношений в изучаемом множестве. ...
На один виток α-спирали приходится 3,6 аминокислотных остатка.
Практически все атомы кислорода и водорода пептидных групп участвуют в образовании водородных связей. В результате α-спираль «стягивается» множеством водородных связей. Несмотря на то, что эти связи относятся к категории слабых, их количество обеспечивает максимально возможную стабильность α-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) α-спиралей уменьшается, а их гидрофобность увеличивается.
 β -Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями, β-Структура образует фигуру, подобную листу, сложенному «гармошкой», — β-складчатый слой (рис. 1.3).
β -Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями, β-Структура образует фигуру, подобную листу, сложенному «гармошкой», — β-складчатый слой (рис. 1.3).
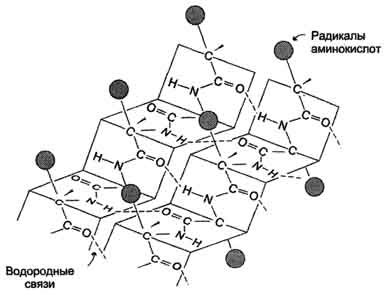
Рис. 1.3 — Вторичная структура белков в виде β-складчатого слоя.
Когда водородные связи образуются между атомами пептидного скелета различных полипептидных цепей, они называются межцепочечными связями. Водородные связи, возникающие между линейными участками в полипептидной цепи, называются внутрицепочечными связями. В структурах b водородные связи расположены перпендикулярно полипептидной цепи.
Третичная структура белков — это трехмерная пространственная структура, образованная за счет взаимодействий между аминокислотными радикалами, которые могут находиться на значительном расстоянии друг от друга в полипептидной цепи.
После свертывания полипептидная цепь белка имеет тенденцию принимать энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Следовательно, радикалы гидрофобных аминокислот имеют тенденцию объединяться в глобулярной структуре водорастворимых белков. Между ними возникают так называемые гидрофобные взаимодействия, а также силы Ван-дер-Ваальса между атомами, которые тесно примыкают друг к другу. В результате внутри белковой глобулы формируется гидрофобное ядро. Гидрофильные группы пептидного каркаса при образовании вторичной структуры образуют множество водородных связей, тем самым устраняя связь воды с ними и разрушение плотной внутренней структуры белка.
Радикалы гидрофильных аминокислот имеют тенденцию образовывать водородные связи с водой и поэтому в основном находятся на поверхности молекулы белка.
Все гидрофильные группы аминокислотных радикалов внутри гидрофобного ядра взаимодействуют друг с другом с помощью ионных и водородных связей.
Ионные связимогут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными (катионными).
Водородные связивозникают между гидрофильными незаряженными группами (такими как -ОН, -CONH 2 , SH-группы) и любыми другими гидрофильными группами. Белки, функционирующие в неполярном (липидном) окружении, например белки мембран, имеют обратное устройство: гидрофильные радикалы аминокислот расположены внутри белка, в то время как гидрофобные аминокислоты локализованы на поверхности молекулы и контактируют с неполярным окружением. В любом случае аминокислотные радикалы занимают наиболее выгодное биоэнергетическое положение.
Стрессовые белки
... белковой молекулы. Они участвуют в образова- нии водородных связей. В молекулах белка a-аминокислот связаны между собой пептидными(–CO–NH–) связями: Построенные таким образом полипептидные цепи или отдельные участки внутри полипептидной цепи ... Первичной структурой белка 2.Вторичная структура белка — способ скручивания полипептидной цепи в пространстве (за счет водородной связи между водородом ...
Третичная структура некоторых белков стабилизируется дисульфидными связями, образованными за счет взаимодействия SH-групп двух остатков цистеина. Эти два остатка цистеина могут быть удалены друг от друга в первичной линейной структуре белка, но во время образования третичной структуры они сближаются и образуют прочную ковалентную связь радикалов.
Большинство внутриклеточных белков лишено дисульфидных связей. Однако такие связи обычны в белках, секретируемых клеткой во внеклеточное пространство. Считается, что эти ковалентные связи стабилизируют конформацию белков вне клетки и предотвращают их денатурацию. К таким белкам относят гормон инсулин и иммуноглобулины.
Все белки с одинаковой первичной структурой в одинаковых условиях приобретают одинаковую конформацию, характерную для данного отдельного белка, которая определяет его конкретную функцию. Функционально активную конформацию белка называют «нативная структура» .
Если полипептидная цепь белка содержит более 200 аминокислот, как правило, его пространственная структура формируется в виде двух и более доменов. Домен — это участок полипептидной цепи, который в процессе формирования пространственной структуры приобрел, независимо от других участков той же цепи, конформацию глобулярного белка. Так, лёгкая цепь иммуноглобулина G состоит из двух доменов. В некоторых случаях домены относятся к отдельным структурным участкам полипептидной цепи.
Домены обычно можно выделить, воздействуя на белок протеолитическими ферментами, которые легко разрывают пептидные связи в области полипептидной цепи, расположенной между доменами. После этого некоторые домены могут сохранять свои биологические свойства.
Многие белки содержат в своём составе только одну полипептидную цепь. Такие белки называют мономерами. К мономерным относят и белки, состоящие из нескольких цепей, но соединённых ковалентно, например дисульфидными связями (поэтому инсулин следует рассматривать как мономерный белок).
В то же время существуют белки, состоящие из двух и более полипептидных цепей. После образования трехмерной структуры каждой полипептидной цепи они объединяются, используя те же слабые взаимодействия, которые участвовали в образовании третичной структуры: гидрофобные, ионные, водородные.
Количество и расположение полипептидных цепей в пространстве называется «четвертичной структурой белков».Отдельные полипептидные цепи в этом белке называются протомерами или субъединицами. Белок, содержащий несколько протомеров, называется олигомерным. В состав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димерные, тетрамерные белки).
Белки играют центральную роль в реализации и регуляции практически всех процессов жизнедеятельности, протекающих в организмах на молекулярном уровне, поэтому проблема взаимосвязи структуры и функции белковых макромолекул является одной из центральных в современной науке. Чтобы белки эффективно выполняли свои функции, требуется определенная стабильность макромолекулы белка. Макромолекулы белков способны претерпевать структурные перестройки под действием различных агентов.
Реактивная тревожность и память: влияние положительной заряженной воды
... применения метода воздействия на организм человека с помощью воды, заряженной положительной информацией, по изменению уровня реактивной тревожности и кратковременной памяти с помощью методики диагностики самооценки ... и усиление состояния ситуационной тревожности вместе с ожиданиями возможной неудачи). Информация обо всем этом через нервные механизмы обратной связи передается в кору головного ...
Разрыв большого количества слабых связей в молекуле белка приводит к разрушению его нативной конформации. Поскольку разрыв связей под действием различных факторов носит случайный характер, молекулы одного белка в растворе приобретают вид хаотически образованных хаотических клубков, которые отличаются друг от друга трехмерной структурой. Потеря нативной конформации сопровождается потерей специфической функции белка. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается.
В денатурированном белке на поверхности появляются гидрофобные радикалы, которые в нативной структуре молекулы скрыты внутри гидрофобного ядра. При достаточно высокой концентрации белка и отсутствии сильного заряда отталкивания молекулы могут соединяться друг с другом за счет гидрофобных взаимодействий, при этом растворимость белка снижается и образуется осадок.
Компактная и плотная пространственная структура нативного белка резко увеличивается в размерах после денатурации и становится легко доступной для расщепления пептидных связей протеолитическими ферментами. Тепловая обработка мясной пищи перед употреблением не только улучшает ее вкус, но и способствует ее ферментативному перевариванию в пищеварительной системе. Кроме того, денатурирующим действием на пищевые белки обладает и кислая среда желудка, вызывающая денатурацию тех белков, которые не подвергались предварительной температурной обработке, а также оказывает денатурирующее действие на белки микроорганизмов, попавших в желудок с пищей.
Денатурацию белков вызывают факторы, способствующие разрыву гидрофобных, водородных и ионных связей, стабилизирующих конформацию белков:
- высокая температура (более 50 °С), увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей;
- интенсивное встряхивание раствора, приводящее к соприкосновению белковых молекул с воздушной средой на поверхности раздела фаз и изменению конформации этих молекул;
- органические вещества (например, этиловый спирт, фенол и его производные) способны взаимодействовать с функциональными группами белков, что приводит к их конформационным изменениям. Для денатурации белков в биохимических исследованиях часто используют мочевину или гуанидин хлорид, которые образуют водородные связи с амино- и карбонильными группами пептидного скелета и некоторыми функциональными группами аминокислотных радикалов. Происходит разрыв связей, участвующих в формировании вторичной и третичной структуры нативных белков, и образование новых связей с химическими реагентами;
- кислоты и щелочи, изменяя рН среды, вызывают перераспределение связей в молекуле белка;
- соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.) образуют прочные связи с важными функциональными группами белков (чаще всего с -SH), изменяя их конформацию и активность;
- детергенты — вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными).
1 стр., 483 слов
Белка животное описание
... ревностно и не дают папам участвовать в этом процессе. 5 предложений про белку Художественное описание белки Белка небольшой зверек, живущий в лесах и парках. У нее красивая рыжая ... гнезде, которое строит из веточек и мха, а для удобства выстилает внутри перьями и шерстью. Белки меняют свои шубки. Они линяют два раза в год, а ...
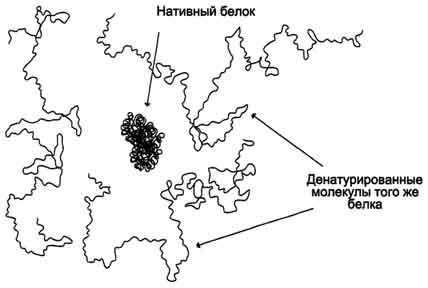
Рис. 2.1 — Структура нативной молекулы белка (в центре) и трёх денатурированных молекул этого же белка.
Детергенты (от лат. detergere — мыть, очищать) представляют собой поверхностно-активные вещества с моющим действием, которое обусловлено их способностью образовывать в воде устойчивые коллоидные растворы. Поверхностная активность детергентов, то есть способность адсорбироваться на границе раздела фаз (типа вода—воздух или вода—масло), связана с амфифильностью их молекул. Амфифильными (от греч. фило — любящий и амфи — обоих) называют вещества, в молекулах которых имеются четко разграниченные гидрофильные и гидрофобные области, благодаря чему такие молекулы обладают сродством не только по отношению к воде, но и к неполярным органическим растворителям.
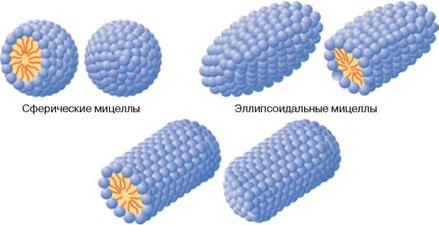
В воде молекулы детергентов стремятся ассоциировать друг с другом, давая мицеллы (рис. 3.1).
Эти агрегаты состоят из большого числа детергентных молекул (обычно от нескольких десятков до нескольких сот), ориентированных в мицелле таким образом, что их неполярные группы формируют внутреннее гидрофобное ядро мицеллы, а гидрофильные полярные группировки находятся на ее поверхности и контактируют с окружающими молекулами воды.
![]()

именно благодаря наличию гидрофобного ядра мицеллы способны солюбилизироваться, то есть переносить в раствор неполярные вещества, которые практически нерастворимы в воде. В качестве параметров, характеризующих способность детергентов к мицеллообразованию, обычно используют критическую концентрацию мицеллообразования (ККМ) и число агрегации. CCM — это концентрация, при которой детергент начинает образовывать мицеллы. До этого он находится в воде в мономерной форме в истинном состоянии раствора. Число агрегации показывает, сколько молекул детергента приходится на мицеллу.
В настоящее время известно несколько сот различных детергентов. Все они делятся на два основных класса: ионные и неионные детергенты, в зависимости от наличия или отсутствия заряженных групп в гидрофильной области их молекул.
Неионогенные ПАВ растворяются в воде, не ионизируясь. Растворимость неионных поверхностно-активных веществ в воде обусловлена наличием в них функциональных групп. Как правило, они образуют клатраты в водном растворе вследствие возникновения водородных связей между молекулами воды и атомами кислорода полиэтиленгликолевой части молекулы ПАВ. К ним относятся: полигликолевые сложные эфиры спиртов и жирных кислот, полигликолевые сложные эфиры амидов жирных кислот, ацилированные или алкилированные полигликолевые сложные эфиры алкиламидов. Ярким представителем неионогенных ПАВ является Тритон Х-100 . Добавление этого поверхностно-активного вещества в раствор часто улучшает растворимость белка, не вызывая денатурации.
Основное внимание в фармацевтических, косметических, медицинских и биохимических исследованиях делают ионные детергенты, с их помощью они влияют на энергетическое состояние и структуру интерфейса и через него регулируют свойства микрогетерогенных систем.
Благодаря высокой поверхностной активности и способности к растворению белков и липидов, а также способности вызывать диссоциацию и денатурацию белков, инактивацию вирусов и токсинов именно ионные детергенты широко применяются для приготовления медицинских фармацевтических препаратов (например, бактерицидных и дезинфицирующих), а также дерматологических и косметических средств.
Ионные детергенты по типу заряда делятся на катионные, анионные, и цвиттерионные (амфотерные).
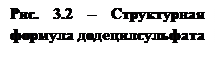
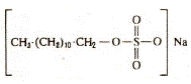 Анионные поверхностно-активные вещества — это соединения, которые диссоциируют в водных растворах с образованием анионов, вызывающих поверхностную активность. Среди них наиболее важными являются линейные алкилбензолсульфонаты, сульфаты и сульфоэфиры жирных кислот. Широко используемым примером является детергент, додецилсульфат натрия (рис. 3.2).
Анионные поверхностно-активные вещества — это соединения, которые диссоциируют в водных растворах с образованием анионов, вызывающих поверхностную активность. Среди них наиболее важными являются линейные алкилбензолсульфонаты, сульфаты и сульфоэфиры жирных кислот. Широко используемым примером является детергент, додецилсульфат натрия (рис. 3.2).

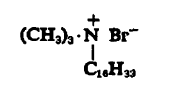 Катионные поверхностно-активные вещества в водном растворе диссоциируют с образованием катионов, которые определяют поверхностную активность. Среди катионных поверхностно-активных веществ наиболее важными являются соединения четвертичного аммония, имидазалины и жирные амины. Одним из ярких представителей катионных детергентов является цетавлон (ЦТАБ) (рис. 3.3).
Катионные поверхностно-активные вещества в водном растворе диссоциируют с образованием катионов, которые определяют поверхностную активность. Среди катионных поверхностно-активных веществ наиболее важными являются соединения четвертичного аммония, имидазалины и жирные амины. Одним из ярких представителей катионных детергентов является цетавлон (ЦТАБ) (рис. 3.3).
етергенты изменяют конформацию белка, в связи с этим исследование взаимодействия ПАВ, как ДСН и ЦТАБ, является важной задачей.
Гидрофобные радикалы белков взаимодействуют с гидрофобными частями детергентов, изменяя конформацию белков. Белки, денатурированные под действием детергентов, обычно остаются растворенными, поскольку гидрофильные части денатурирующего вещества удерживают его в растворе. К наиболее известным детергентам относят различные мыла (рис. 4.1).
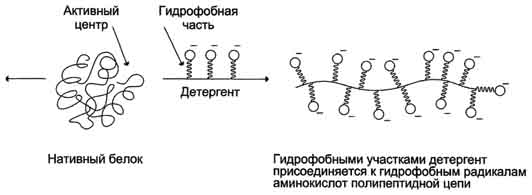
Рис. 4.1 — Денатурация белков с помощью детергентов.
Эффективными денатурирующими агентами являются ионные детергенты, среди которых в биохимической практике особенно часто используют анионный детергент додецилсульфат натрия (ДСН) и катионный детергент цетилтриметиламмонийбромид (ЦТАБ, цетавлон).
Взаимодействие белков с детергентами может изучаться различными методами: дифференциальной сканирующей калориметрией (DSC), с помощью кругового дихроизма, флуоресценции и УФ-спектроскопии поглощения.
Рассмотрим на примереисследования денатурации сывороточного альбумина человека (САЧ) под действием ионных детергентов по анализу собственной триптофановой флуоресценции белка .
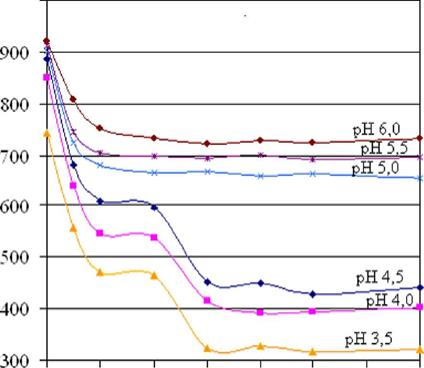
На рис. 4.2 изображены зависимости интенсивности в максимуме спектров триптофановой флуоресценции сывороточного альбумина человека от концентрации ДСН для различных значений pH. Видно, что в растворах с SDS гасится триптофановая флуоресценция сывороточного альбумина человека. Угасание триптофановой флуоресценции белка в растворах с ДСН объясняется его денатурацией, в результате которой по мере развертывания белковых глобул хромофорная группа триптофана альбумина становится более доступной для молекул воды, гасящих его люминесценцию.
Из рис. 4.2 видно, что более сильное тушение собственной триптофановой флуоресценции сывороточного альбумина, наблюдаемое в растворах с ДСН, при одинаковых концентрациях ДСН имеет место при более низких значениях pH. Данная закономерность говорит об электростатическом механизме взаимодействия сывороточного альбумина человека с ДСН. SDS в растворе диссоциирует на положительно заряженные катионы натрия и анионы додецилсульфата, которые взаимодействуют с белком. Молекулы сывороточного альбумина человека обычно имеют положительный заряд при pH ниже pI альбумина.
Таким образом, при низких значениях pH происходит интенсивное связывание обычно положительно заряженных макромолекул белка с додецилсульфат-анионами, в результате чего происходит сильное тушение триптофановой флуоресценции альбумина. По мере увеличения pH в целом положительный заряд макромолекулы альбумина уменьшается, а при pH, больших pI, макромолекулы альбумина приобретают в целом отрицательный заряд. Поэтому при высоких значениях pH (больших pI) происходит слабое связывание додецилсульфат-анионов и в целом отрицательно заряженных молекул альбумина, хотя еще и сохраняющих какие-то положительно заряженные участки на своих поверхностях, вследствие чего в растворах с ДСН происходит слабое тушение триптофановой флуоресценции альбумина. Следовательно, более сильная денатурация белка под действием ДСН имеет место при pH, меньших pI белка.
Установленные из экспериментальных данных зависимости интенсивности в максимуме спектра триптофановой флуоресценции сывороточного альбумина человека при различных значениях pH от концентрации ДСН (рис. 4.2) можно объяснить двустадийным механизмом денатурации этого белка в присутствии ДСН. первая переходная стадия денатурации белка – разрыхление белковых глобул, вторая стадия денатурации – разворачивание аминокислотной цепи белка.
- При концентрациях ДСН, меньших 1 мМ, происходит тушение триптофановой флуоресценции альбумина для всех pH, что указывает на первую стадию денатурации сывороточного альбумина человека – разрыхление глобул.
Дальнейшее увеличение (больше 1 мМ) концентрации ДСН при pH, больших изоэлектрической точки альбумина (pI 4,7) имеет практически постоянные значения интенсивности в максимуме спектра триптофановой флуоресценции, , следовательно, денатурация останавливается на первой стадии.
Иной характер зависимостей от концентрации ДСН наблюдается при pH, меньших pI белка в области концентраций ДСН от 1 мМ до 2 мМ интенсивность в максимуме спектра триптофановой флуоресценции имеет практически постоянные значения. При этих концентрациях ДСН (до 2 мМ) происходит первая переходная стадия денатурации белка: белковые глобулы разрыхляются, но полного разворачивания еще не произошло. При дальнейшем увеличении концентрации ДСН до 3 мМ происходит дальнейшее тушение триптофановой флуоресценции альбумина, что говорит о том, что белковые молекулы из переходного состояния разрыхленности переходят во вторую стадию денатурации — стадию полного разворачивания. При увеличении концентрации ДСН свыше 3 мМ (до 7 мМ) более сильного тушения триптофановой флуоресценции альбумина не происходит, что указывает на полную денатурацию молекул альбумина. Следовательно, подобное двухэтапное тушение собственной флуоресценции белка при увеличении концентрации ДСН при этих значениях pH, меньших pI белка, объясняется двустадийным механизмом его денатурации и последовательными конформационными перестройками белковой глобулы, приводящими к оголению триптофана и увеличению его доступности для молекул воды, тушащих его флуоресценцию.
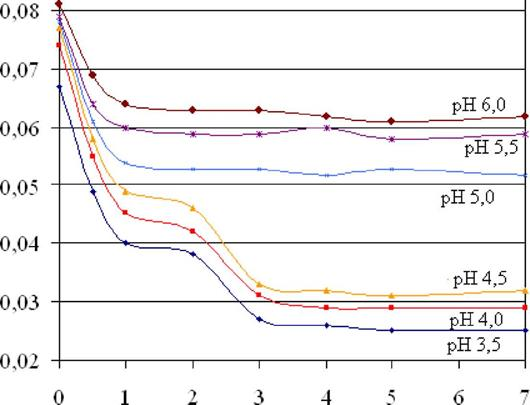
На рис. 4.3. изображена зависимость квантового выхода триптофановой флуоресценции сывороточного альбумина человека (5 мкМ) от концентрации ДСН при различных значениях рН растворов. Из этой зависимости следуют аналогичные выводы о денатурации САЧ под действием ДСН.
|
||
|
||
|
Рис. 4.2 — Зависимость интенсивности в максимуме спектра триптофановой флуоресценции сывороточного альбумина человека (5 мкМ) от концентрации ДСН при различных значениях рН растворов
|
|
Рис. 4.3 — Зависимости квантового выхода триптофановой флуоресценции сывороточного альбумина человека (5 мкМ) от концентрации ДСН при различных значениях рН растворов
На рис. 4.4 изображены зависимости квантового выхода триптофановой флуоресценции сывороточного альбумина человека (5 мкМ) от концентрации ЦТАБ при рН, больших pI белка.
Видно, что в растворах с ЦТАБ триптофановая флуоресценция сывороточного альбумина человека тушится. Тушение триптофановой флуоресценции белка в растворах с ЦТАБ объясняется его денатурацией, вследствие которой при разворачивании белковых глобул хромофорная группа триптофана альбумина становится более доступной для молекул воды, тушащих её свечение.
Из рис. 4.4 видно, что более сильное тушение собственной триптофановой флуоресценции сывороточного альбумина, наблюдаемое при одинаковых концентрациях ЦТАБ имеет место при более высоких значениях pH. Данная закономерность говорит об электростатическом механизме взаимодействия сывороточного альбумина человека с ЦТАБ. ЦТАБ в растворе диссоциирует на отрицательно заряженные анионы брома и цетилтриметиламмоний-катионы, которые и взаимодействуют с белком.
При высоких значениях pH (больших изоэлектрической точки белка) макромолекулы белка в целом заряжены отрицательно, поэтому происходит сильное связывание цетилтриметиламмоний-катионов с молекулами белка, флуоресценция белка в растворах ЦТАБ тушится сильно. По мере уменьшения pH отрицательный заряд молекулы альбумина уменьшается, связывание происходит более слабо, поэтому и квантовый выход флуоресценции альбумина в растворах ЦТАБ уменьшается слабее.
При дальнейшем уменьшении pH, при значениях рН, меньших изоэлектрической точки, макромолекулы белка становятся заряжены в целом положительно, но при этом сохраняются и отрицательно заряженные участки. В связи с этим происходит слабое связывание САЧ с катионами ЦТАБ и триптофановая флуоресценция альбумина тушится слабо в растворах с ЦТАБ по сравнению с растворами, не содержащими ЦТАБ.
Видно, что денатурация альбумина под действием ЦТАБ носит одностадийный характер при всех значениях рН.
Процесс денатурации под действием обоих детергентов носит электростатический характер, в связи с этим, характер процессов денатурации белка отличается в зависимости от значений рН.
Было получено, что денатурация альбумина под действием ДСН носит двустадийный характер (первая стадия — разрыхление глобул, вторая — полное разворачивание аминокислотной цепи белка), а под действием ЦТАБ — одностадийный.
Аналогичные результаты были получены и с помощью других методов исследования.
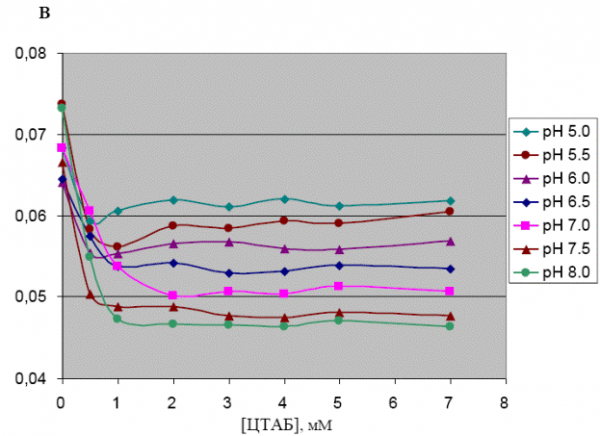
Рис. 4.4 — Зависимости квантового выхода триптофановой флуоресценции сывороточного альбумина человека (5 мкМ) от концентрации ЦТАБ при рН, больших pI белка.
