Введение
Изучение структуры и функции мембран в норме и при патологии существенно расширяет наши представления о механизмах возникновения и развития патологических процессов на уровне клетки и целого организма. Одним из мощных факторов, повреждающих клеточные мембраны, является образование свободных радикалов, вызывающих в клетке неконтролируемые реакции. В небольших количествах свободные радикалы всегда присутствуют в клетке. Однако при воздействии ультрафиолетового или ионизирующих излучений, количество свободных радикалов в клетке существенно возрастает. Наиболее интенсивно свободные радикалы образуются при аутоокислении ненасыщенных жирных кислот в процессе перекисного окисления липидов (ПОЛ).
Перекисное окисление липидов является альтернативным процессу биологического окисления. При биологическом окислении кислород присоединяется к атомам водорода лишь в заключительной цепи реакций, происходящих в митохондриях. Как промежуточные, так и конечные продукты биологического окисления, не токсичны. При перекисном окислении образуются продукты аутоокисления: свободные радикалы, перекиси, альдегиды, обладающие чрезвычайной токсичностью для клетки.
Особенно подвержены перекисному окислению ненасыщенные жирные кислоты фосфолипидов мембран. Атом водорода, расположенный у них рядом с двойной связью, очень непрочно связан с соответствующим атомом углерода. Такой атом углерода называют α-метиленовым, а его водород – аллильным. Например, в линолевой кислоте, имеющей две двойные связи, α-метиленовыми будут атомы углерода в 8 и 11 положениях.
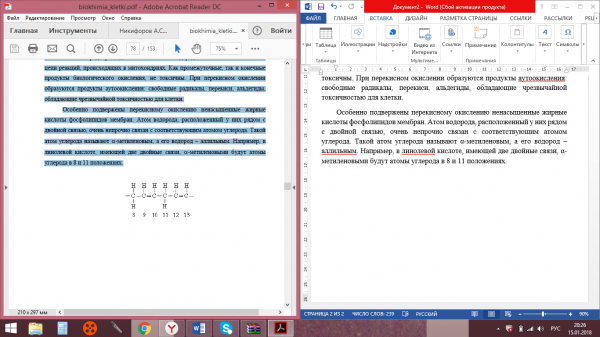
Аллильный водород очень быстро переходит к окислителю, в результате чего возникает алкильный радикал , который затем превращается в гидроперекись:
Таким образом, гидроперокси – группа присоединяется к α-метиленовому углероду жирных кислот. Это и вызывает цепочку реакций, изменяющих структуру, а затем и функции мембран.
-
Свободные радикалы
3 стр., 1175 словИндукторы и ингибиторы микросомального окисления
... - дисульфирам, ритонавир Заключение Микросомальное окисление - важнейший метаболический процесс, ... клетке определяется его антиоксидантными свойствами. Фактически глутатион не только защищает клетку от токсичных свободных радикалов, ... у животных, которым вводили индуктор фенобарбитал, увеличивается площадь мембран эндоплазматического ретикула, которая достигает 90% всех мембранных структур клетки, ...
Свободный радикал может образоваться при отщеплении от молекулы одного атома иди группы атомов. У молекулы появляется неспаренный электрон на внешней (валентной) атомной орбите. Наличие неспаренного электрона обусловливает высокую активность свободного радикала, который, вступая в химические реакции, приобретает недостающий электрон. Свободный радикал с одним неспаренным электроном называется монорадикалом, а с двумя – бирадикалом. Радикал может нести избыточный электрический заряд, и тогда его называют ион-радикалом. В основном, свободные радикалы являются неустойчивыми, они могут существовать сотые доли секунды (метил-, гидроксил- радикалы), есть относительно устойчивые радикалы, для которых характерно наличие в составе молекулы ароматических колец. Нестабильность радикалов обусловлена: 1) их высокой способностью к рекомбинации друг с другом; 2) их большой реакционной способностью по отношению к многим нейтральным молекулам. При этом протекают химические реакции замещения, рекомбинации, присоединения, полимеризации и др.
В биологических системах можно выделить несколько типов свободных радикалов. Одни из них образуются в качестве нормальных продуктов обмена веществ, например, образование эндоперекисей при аутоокислении холестерола. Другие возникают при измененных условиях жизнедеятельности, к ним относятся свободные радикалы воды и органических молекул , образующиеся при действии на клетку ионизирующих излучений, различных токсических веществ.
Комиссия по номенклатуре радикалов в 1990 г предложила следующие названия радикалов:
|
Формула |
Структура |
Название |
|
О 2 ˙ |
[ ˙ OO] |
Синглетный кислород |
|
O 2 |
[ ˙ OO˙ ] |
Диоксиген |
|
O 2 ˙ — |
[ ˙ OO— ] |
Диоксид (супероксид) |
|
O 3 |
|
Триоксген |
|
H |
— |
Алкил |
|
HO ˙ |
— |
Гидроксил |
|
HO 2 ˙ |
[HOO ˙ ] |
Гидродиоксид |
|
H 2 O2 |
— |
Перекись водорода |
|
RO ˙ |
— |
Алкоксил |
|
RO 2 ˙ |
[ROO ˙ ] |
Алкилдиоксил |
|
ROOH |
— |
Алкилгидропероксил |
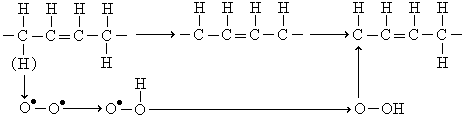
Для образования свободных радикалов существенное значение имеют так называемые активные формы кислорода (АФК).
Под АФК понимают продукты восстановления кислорода, образующиеся при окислительно-восстановительных процессах в организме. К ним относятся синглетный кислород, супероксидный радикал и свободные радикалы, образующиеся при взаимодействии кислорода с водородом. Свыше 5% потребляемого кислорода восстанавливается в супероксид-анион, а около 10% О 2 превращается в H2 O2 .
Обычный молекулярный кислород находится в триплетном состоянии, его обозначают О=О. Молекула О 2 содержит 2 неспаренных электрона, одновременно принадлежащих двум её атомам и имеющих одинаково направленные параллельные спины, что придает молекулярному кислороду парамагнитные свойства.
Молекула кислорода является достаточно стабильной и этому свойству она обязана именно своим двум неспаренным электронам.
Синглетный кислород образуется при переходе электрона внутри молекулы между внешними орбиталями и в связи с этим обладает дополнительной энергией, его обозначают как радикал О˙–О. Электронно-возбужденное синглетное состояние кислорода не содержит неспаренных параллельных электронов и является гораздо более реакционно-способным, чем основное состояние. Одноэлектронное образование синглетного кислорода является одним из путей восстановления кислорода, с которым связано образование свободнорадикального продукта. При одноэлектронном восстановлении в качестве промежуточных продуктов могут возникать супероксид O 2 ˙– , перекись водорода Н2 О2 и гидроксильный радикал • OH. Для полного восстановления О2 необходимо 4 электрона.
Супероксидный анион представляет собой отрицательно заряженный свободный радикал O 2 ˙– . Считается, что супероксид-анион дает ограниченный токсический эффект. ˙ОН – монорадикал, образуется при взаимодействии с водородом. Эти продукты также очень реакционноспособны и их присутствие может представлять угрозу для целостности живых систем.
На самом деле, ˙ОН – наиболее мутагенный продукт ионизирующей радиации – представляет собой чрезвычайно мощный окислитель, который может атаковать все органические соединения. Гидроксильный радикал с высокой скоростью реагирует практически со всеми молекулами клетки, включая ДНК, белки, липиды, углеводы. Чувствительными к действию радикалов ˙ОН и O 2 ˙– являются сукцинатдегидрогеназа, цитохромоксидаза, ксантиноксидаза.
Свободные радикалы обладают высокой химической активностью и взаимодействуя с молекулами , могут превращать их также в свободные радикалы. Монорадикал ˙ОН, реагируя с водородом дает атом-радикал Н˙ и образуется вода:
Н 2 + ˙ОН = Н2 О + Н˙;
с оксидом углерода монорадикал ˙ОН дает СО 2 и также атом-радикал водорода:
СО + ˙ОН = СО 2 + Н˙
Взаимодействуя с белками, АФК снижают содержание отдельных пептидов, образуют продукты белковой интеграции и липопротеиновые комплексы. В пределах клеточной мембраны особенно подвержены взаимодействию со свободными радикалами ненасыщенные жирные кислоты и алифатические спирты (сфингозин), ненасыщенные углеводороды (сквален, каротины), ненасыщенные стерины. Наличие в структуре мембран многих ненасыщенных соединений способствует их легкому окислению. Перекисному окислению также подвергаются ароматические аминокислотные остатки белков. Отдавая свой водород свободным радикалам, они деформируются. В результате перекисного окисления образуются свободные радикалы •ОН, вытесняющие атомы водорода из жирных кислот и белков. Атомы водорода, соединяясь с гидроксильными группами, образуют в гидрофобном слое мембраны молекулы воды. Происходит распад на фрагменты жирных кислот и пептидов с образованием отрицательно заряженных карбоксильных групп, приводящих к повреждению мембраны и увеличению её проницаемости.
-
Свободнорадикольный механизм перекисного окисления липидов
Процесс образования перекисей липидов в биологических мембранах осуществляется по цепному свободнорадикальному механизму, подобно тому как по цепному механизму происходит деление ядер урана. Особенность цепных реакций состоит в том, что свободные радикалы, реагируя с другими молекулами, не исчезают, а превращаются в другие свободные радикалы.
Наличие в радикалах одиночных электронов обусловливает их свойство присоединять электрон. Поэтому радикалы выполняют роль окислителей. Присоединяя атом водорода, они выполняют функцию дегидрирования. Молекула кислорода может активироваться при взаимодействии с ионом железа:
Fe 2+ + O2 = Fe3+ + (O• – O– )
Получается супероксидный радикал O 2 •– . Он энергично реагирует с органическими молекулами, отрывая водород или присоединяясь к ненасыщенным связям. Поэтому ионы железа катализируют цепные реакции окисления молекулярным кислородом.
В любом химическом свободнорадикальном процессе принято рассматривать три характерные стадии: реакцию зарождения цепи, её продолжение и реакцию обрыва цепи. Свободнорадикальное окисление начинается с реакции инициирования цепи. Инициаторами могут быть химические реакции, связанные с изменением валентности иона металла (Cu 2+ , Fe2+ ).
При окислении ионов железа молекулярным кислородом в растворе образуются как O2 •– , так и гидродиоксид- радикал НO2•
Fe 2+ + O2 = Fe3+ + O2 •-
Fe 2+ + O2 + H+ = Fe3+ + НO2 •
Появление бирадикала дает начало цепи при взаимодействии его с молекулой жирной кислоты RH:
НO 2 • + RH = H2 O2 + R• ,
при этом образуется перекись водорода , а радикалы R • подвергаются аутоокислению с образованием алкилдиоксил – радикала:
R
- + O 2 = RO2 • .
Перекисный радикал может вступать во взаимодействие с новой молекулой ненасыщенной жирной кислоты, при этом образуется следующая молекула радикала R и алкилгидропероксид:
RO 2 • + RH = R• + ROOH.
Эта реакция начинает новый этап свободнорадикального цепного процесса, который называется продолжением цепи. Следует отметить, что энергия активации реакций инициирования и продолжения цепи практически равна нулю и поэтому весь процесс имеет самоускоряющийся характер. Чередование двух последних реакций приводит к цепному окислению:

Число радикалов (R • + RO2 • ) определяет активность процесса в целом, при этом число гидроперекисей липидов может возрастать.
Далее следуют реакции разветвления, когда гидроперекиси разлагаются, инициируя новые цепи. Разветвление происходит в присутствии ионов Fe 2+ , под действием ультрафиолетового, ионизирующего излучений, или значительно реже – спонтанно.
ROOH + Fe 2+ = RO• + Fe3+ + OH–
Не все радикалы RO 2 • и R• продолжают цепь, часть их рекомбинируют друг с другом, дают неактивные продукты и приводят к обрыву цепи. Рекомбинация радикалов:
R • + R = • RR
RO 2 • + R = • ROOR
RO 2 • + RO2 • + H+ = ROH + R=O + O2 + hν (хемилюминесценция).
Помимо спонтанного обрыва цепей, прерывание цепей возможно:
а) при взаимодействии с Fe 2+
RO 2 • + Fe2+ + H+ = ROOH + Fe3+
R • + Fe2+ + H+ = RH + Fe3+
б) при взаимодействии с антиоксидантами (А):
AH + R • = A• + RH
AH + RO 2 • = A• + ROOH
A • + RO2 • → неактивные продукты
A • + A• → неактивные продукты
Самым распространенным антиоксидантом является витамин E. Наиболее активен витамин E в относительно низких концентрациях (in vitro 10 -6 M), при повышении концентрации, его антиоксидантная активность снижается. Это объясняется усилением реакции
A • + RH = AH + R• ,
которая при низких концентрациях витамина Е не дает существенного вклада в реакцию инициирования новых цепей.
-
Продукты перекисного окисления липидов
В результате самоускоряющихся реакций свободнорадикального окисления образуется множество продуктов ПОЛ. При взаимодействии свободных радикалов с неокисленными молекулами непредельных жирных кислот образуются липидные гидроперекиси (ROOH).
Липоперекиси – неустойчивые вещества, легко подвергаются дальнейшим превращениям с образованием целого ряда более устойчивых вторичных продуктов окисления: альдегидов, кетонов, ряда низкомолекулярных кислот (муравьиной, уксусной, масляной), эпоксисоединений и многих других. Эти вещества являются токсичными для клетки , приводят к нарушению функций мембран и метаболизма в целом.
В случае линоленовой кислоты, имеющей три двойные связи, пос-ледовательность накопления продуктов ПОЛ может быть представлена следующим образом:
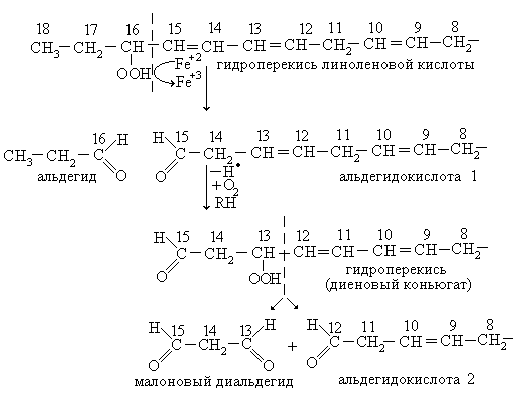
Накопление продуктов ПОЛ имеет существенное значение для определения интенсивности этого процесса.
Продуктами ПОЛ являются:
1. Гидроперекиси липидов (ROOH).
2. Диеновые коньюгаты (липоперекиси с сопряженными двойными связями) = CH – CH = CH – CH2 –
3. Перекисные радикалы: H • , • OH, HO2 •
4. Альдегиды: 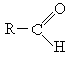
5. Малоновый диальдегид 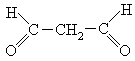
Повреждающее действие продуктов перекисного окисления липидов на белки реализуется за счет их взаимодействия с -SH, — NH 2 и CH3 – группами. Продукты ПОЛ могут образовывать комплексы с белками и инициировать полимеризацию белковых молекул, что способствует ещё большему разрушению клеточных структур, подавляет функцию мембранносвязанных ферментов. Перекиси полиненасыщенных жирных кислот, диальдегиды и ряд других вторичных продуктов ПОЛ, взаимодействуя с N-концевыми группами аминокислот, входящих в белки, образуют конъюгированные соединения – так называемые основания Шиффа, которые обладают большой реакционной способностью и могут производить межмолекулярные «сшивки», а также вступать в реакции полимеризации и поликонденсации. В результате этих реакций также теряются присущие биополимерам функциональные свойства. Продукты реакций между малоновым диальдегидом с белками, фосфолипидами и нуклеиновыми кислотами по размеру в несколько раз превосходят исходные молекулы. В результате прочных связей они не подвергаются разрушению и накапливаются с возрастом. К таким биополимерам относится липофусцин, называемый «пигментом старости». Полагают, что липофусцин образуется при взаимодействии продуктов распада фосфолипидов с NH2 – группами белков.
Свободнорадикальное окисление липидов играет ведущую роль в развитии ультрафиолетовой эритемы кожи, световых ожогов глаз , радиационных повреждений, отравлений четыреххлористым углеродом, свободные радикалы имеют существенное значение в накоплении необратимых повреждений, приводящих к старению организма.
-
Образование перекиси водорода в клетке
Утилизация кислорода в клетке осуществляется в следующих процессах:
1) биологического окисления в митохондриях, сопряженных с образованием АТФ;
2) аутоокисления и образования свободных радикалов;
3) микросомального окисления, связанного с окислением ксенобиотиков;
4) окисления, сопровождаемого образованием перекиси водорода (Н 2 О2 ).
Рассмотрим три пути образования Н 2 О2 в клетке.
1. Неферментативное образование Н 2 О2 за счет аутоокисления субстратов. Этот путь был рассмотрен ранее для случая взаимодействия гидродиоксид-радикала с ненасыщенной жирной кислотой:
HO 2 • + RH = Н2 О2 + R•
2. Перекись водорода образуется при взаимодействии кислорода с дыхательными ферментами (ДФ) в результате одно- и двухэлектронного восстановления О 2 , причем одновременно с Н2 О2 образуется супероксидный радикал:
ДФ + О 2 = ДФ+ + О2 •–
Далее с ним реагируют движущиеся по дыхательной цепи протоны, образуется Н2О2
2О 2 •– + 2Н+ = Н2 О2 + О2
В свою очередь перекись водорода взаимодействует с супероксидным радикалом и образуется третье вещество этой группы – гидроксильный радикал НО•
H 2 O2 + О2 •– = • OH + OH– + O2 (реакция Габера-Вейсса).
Генерация гидроксильных радикалов в этой реакции протекает очень медленно, но значительно ускоряется в присутствии ионов металлов с переменной валентностью:
Fe 2+ + H2 O2 = Fe3+ + OH– + • OH
Одним из путей образования синглетного кислорода считается обратимая неферментативная реакция взаимодействия супероксидного радикала с протонами, которая дает также перекись водорода:
2О 2 •– + 2Н+ = О2 • + Н2 О2
3. Энзиматическое образование перекиси водорода.
Из интермедиатов кислорода перекись водорода считается наиболее стабильным веществом и, следовательно, наименее реакционноспособным. Ее образование требует больших затрат кислорода. Около 10% всего кислорода , потребляемого организмом, расходуется на ферментативное окисление, осуществляемое оксидазами, локализованными в пероксисомах. Оксидазы катализируют прямые реакции между своими субстратами и кислородом. При этом они восстанавливают О 2 до Н2 O2 .
